Введение
Концепция лимитирующего реагента.
Изображение Фото:Команды Викимедиа
Реагент – это вещество, участвующее в химической реакции и претерпевает трансформацию во время процесса. Эти преобразования часто включают связь между атомами разрывается, образуя новые связи для создания различных соединений, известных как продукции.
Например, при газообразный водород (H2) реагирует с газообразный кислород (O2), вовлеченными реагентами являются водород и кислород. В результате образуется вода (H2O).. Эта фундаментальная концепция реагентов, участвующих в химических реакциях, имеет решающее значение для понимания различных процессов, происходящих на молекулярном уровне, таких как реакции горения или фармацевтический синтез.
Слайд 59 1. Стратегии, базирующиеся на трансформах.Целью таких стратегий

вклад в «дерево синтеза». Таким образом, стратегия, базирующаяся на трансформах,
представляет собой чисто механический перебор всех возможных трансформов. При этом вовсе не каждый путь анализа приводит к удовлетворительному решению.
2. Стратегии, базирующиеся на структуре.
В этих стратегиях определяющая роль принадлежит обнаружению в структуре ТМ потенциального исходного соединения, субъединицы, содержащей определенный ретрон или начального хирального элемента для создания правильных стереосоотношений в ТМ.
3. Стратегии, основанные на топологии.
Эти стратегии предполагают обнаружение связи (или связей), расположение которой, в соответствии с ее положением в ТМ, дает максимальное уменьшение молекулярной сложности. Такие связи называются «стратегическими». Ниже перечислены три основных типа стратегических связей. Это: а) связи, расположенные в середине молекулы; б) связи, идущие из точки ветвления; в) связи, непосредственно присоединенные к циклу.
а)
б)
в)
Слайд 53 1. Вначале следует провести расчленение связей, которые легко

того чтобы в синтезе ввести их в последнюю очередь.2. В
том случае, когда в целевой структуре присутствует трудноудаляемая (а следовательно, и трудновводимая) группа, может быть, её и не следует удалять. В таком случае лучше попытаться найти доступное исходное соединение, которое уже содержит нужную группировку.При анализе как можно раньше следует удалить группы, затрудняющие введение других (например, группу NO2 в ароматических соединениях).3. Трансформ должен удалять как можно больше функциональных групп и, если возможно, стереоцентров.4. Расчленение молекулы следует проводить «малыми укусами» (small bites) на большие осколки. Иными словами, надо добиваться максимального упрощения структуры, разрывая минимальное число связей. Этот принцип является достаточно общим для ретросинтетического анализа. Предпочтение следует отдавать расчленению по стратегическим связям.
Рекомендации по ретросинтетическому анализу
Приоритетные направления и перспективы развития биоорганической химии
Приоритетными направлениями научных исследований в области биоорганической химии являются:
- исследование структурно-функциональной зависимости биологически активных соединений;
- дизайн и синтез новых биологически активных препаратов, включая создание лекарственных средств и средств защиты растений;
- исследование высокоэффективных биотехнологических процессов;
- исследование молекулярных механизмов процессов, происходящих в живом организме.
Ориентированные фундаментальные исследования в области биоорганической химии направлены на изучение структуры и функции важнейших биополимеров и низкомолекулярных биорегуляторов, в том числе белков, нуклеиновых кислот, углеводов, липидов, алкалоидов, простагландинов и других соединений. Биоорганическая химия тесно связана с практическими задачами медицины и сельского хозяйства (получение витаминов, гормонов, антибиотиков и других лекарственных средств, стимуляторов роста растений и регуляторов поведения животных и насекомых), химической, пищевой и микробиологической промышленности. Результаты научных исследований являются основой для создания научно-технической базы технологий производства современных средств медицинской иммунодиагностики, реагентов для медико-генетических исследований и реактивов для биохимического анализа, технологий синтеза субстанций лекарственных препаратов для применения в онкологии, вирусологии, эндокринологии, гастроэнтерологии, а также химических средств защиты растений и технологий их применения для сельского хозяйства.
Решение основных проблем биоорганической химии важно для дальнейшего прогресса биологии , химии и ряда технических наук. Без выяснения строения и свойств важнейших биополимеров и биорегуляторов нельзя познать сущность жизненных процессов, а тем более найти пути управления такими сложными явлениями, как размножение и передача наследственных признаков, нормальный и злокачественный рост клеток, иммунитет, память , передача нервных импульсов и многое другое
В то же время изучение высокоспециализированных биологически активных веществ и процессов, протекающих с их участием, может открыть принципиально новые возможности для развития химии, химической технологии и техники. К проблемам, решение которых связано с исследованиями в области биоорганической химии, относится создание строго специфичных высокоактивных катализаторов (на основе изучения строения и механизма действия ферментов), прямое превращение химической энергии в механическую (на основе изучения мышечного сокращения), использование в технике химических принципов хранения и передачи информации, осуществляемых в биологических системах, принципов саморегулирования многокомпонентных систем клетки, в первую очередь избирательной проницаемости биологических мембран, и многое др. Перечисленные проблемы лежат далеко за пределами собственно биоорганической химии, однако она создает основные предпосылки для разработки этих проблем, обеспечивая главные опорные пункты для развития биохимических исследований, относящихся уже к области молекулярной биологии. Широта и важность решаемых проблем, разнообразие методов и тесная связь с другими научными дисциплинами обеспечивают быстрое развитие биоорганической химии.. Вестник Московского Университета, серия 2, Химия. 1999. Т. 40. № 5. С. 327-329.
Бендер М., Бергерон Р., Комияма М. Биоорганическая химия ферментативного катализа . Пер. с англ. М.: Мир, 1987. 352 С.
Яковишин Л.А. Избранные главы биоорганической химии . Севастополь: Стрижак-пресс, 2006. 196 С.
Николаев А.Я. Биологическая химия . М.: Медицинское информационное агентство, 2001. 496 С.
Поиск лимитирующего реагента: пошаговое руководство
Чтобы определить предельный реагент в химической реакции, следуйте этому шаг за шагом руководство который включает расчет молей каждого реагента, используя мольные отношения из сбалансированного уравнения, и сравнение количества чтобы определить, какой реагент является лимитирующим – читайте дальше, чтобы узнать больше!
Определение молей присутствующих реагентов
Для того, чтобы найти ограничивающий реагент, необходимо определить количество родинок каждого реагента, присутствующего в химической реакции. Это включает в себя преобразование массы каждого реагента в его соответствующее количество молей используя его молярная масса.
скажем, у нас есть 10 грамм кислорода и 20 граммов водорода в реакции с образованием воды. Чтобы определить сколько родинок присутствуют для каждого элемента, нам нужно преобразовать эти массы в их соответствующее молярное количество by разделительный их по их атомному весу (1 моль = атомный вес).
После того, как это преобразование было сделано для всех реагентов, можно использовать сбалансированное химическое уравнение сравнить, сколько продукта будет произведено из каждого количества.
Вычисление молярной массы и преобразование граммов в моли
Чтобы найти предельный реагент в химической реакции, важно сначала переведите массы каждого реагента в моли. Этот шаг включает в себя расчет молярная масса каждого вещества, которое является просто сумма всех атомных масс в одном моле этого вещества
Например, если вы хотите рассчитать молярная масса воды (H2O), вы бы добавили два атома водорода с атомной массой 1 и один атом кислорода с атомной массой 16.
После того, как вы рассчитали молярные массы каждого реагента, вы можете преобразовать их соответствующие массы от граммов до молей by разделительный их по их индивидуальным молярным массам. Это преобразование поможет вам сравнить, сколько каждого реагента присутствует, и определить, какой фактор является ограничивающим в реакции.
Использование молярного отношения в сбалансированном химическом уравнении
Один из обязательных этапов определения ограничивающий реагент использует мольное отношение в сбалансированном химическом уравнении. Это соотношение показывает сколько молей каждого реагента необходимы для производить определенное количество продукции.
Например, рассмотреть реакцию, в которой 2 моля газообразного водорода (H2) реагировать с 1 моль газообразного кислорода (O2) для формирования 2 моля воды (H2O).
2 Н2 + О2 → 2 Н2О
Если у нас есть 4 моля H2 и Доступно 3 моля O2, то мы можем использовать молярное отношение сверху, чтобы определить, что только 3 моля H20 может быть произведено, поскольку у нас сначала заканчивается газообразный кислород, и, следовательно, это будет ограничено предположением.
Сравнение количества реагентов для определения лимитирующего реагента
Чтобы определить ограничивающий реагент в химической реакции необходимо сравнить количества каждого реагента подарок. Сбалансированное уравнение обеспечивает мольные отношения между каждым реагентом и продуктом, позволяющая произвести расчет сколько продукта может быть получено из каждого реагента.
Реагент, производящий меньше продукта, называется лимитирующим реагентом. поскольку он ограничивает количество продукции, которое может быть получено в результате реакции.
Например, рассмотрим реакцию с участием 3 моля газообразного кислорода (O2) и 4 моля газообразного водорода (H2) для формирования вода (H2O). Сравнение этих величин показывает, что существует остался избыток H2 в конце концов O2 прореагировал с H2; следовательно, H2 не расходуется полностью во время этой реакции, что делает его избыток реагента.
Напротив, все Молекулы O2 потребляются в реакции образуется до 1.5 моля H20O.
Путем определения предельного реагента и расчета теоретический выход в зависимости от его количества химики лучше понимают, сколько продукта они должны ожидать от своих реакций, обеспечивая при этом эффективное использование ресурсов и тайм-менеджмент в промышленных условиях.
Реакция гидратации неорганических соединений
Гидратация неорганических соединений представляет собой химическую реакцию, в результате которой соединение присоединяет к себе молекулы воды или ионы гидроксила. Гидратация является одним из важных процессов в химии и имеет широкое применение в различных областях, включая промышленность и медицину.
Гидратация может происходить между различными неорганическими соединениями и водой или водными растворами. Примерами реакций гидратации являются гидратация солей и гидратация окислов. Реакции гидратации могут происходить как с поглощением тепла (эндотермические реакции), так и с выделением тепла (экзотермические реакции).
Важным аспектом реакций гидратации неорганических соединений является образование гидратов. Гидраты представляют собой соединения, в которых определенное количество молекул воды присутствует в кристаллической решетке соединения. Гидраты могут иметь различный состав и структуру в зависимости от условий реакции.
Результатом реакции гидратации обычно является образование гидрата или гидроксида соединения. Гидраты имеют специфические свойства, такие как изменение цвета, понижение температуры плавления и точки кипения, а также изменение растворимости. Эти свойства делают гидраты полезными в различных областях, включая производство лекарств и косметики, обработку металлов и производство аккумуляторов.
Реакция гидратации неорганических соединений является важным процессом в химии и имеет множество применений. Понимание этого процесса позволяет контролировать образование и свойства гидратов, что может быть полезным для различных технологических процессов и промышленных приложений.
Реагент: основные понятия и применение
Реагент — это вещество или соединение, которые используются в химических реакциях для изменения состояния или структуры других веществ. Реагенты могут быть использованы для синтеза новых веществ, проведения анализа, а также в процессах очистки и обработки материалов.
Одним из основных принципов использования реагентов является то, что они иногда могут изменяться или истощаться в результате реакции, что требует их добавления вновь или удаления отходов, образующихся в следствие реакции.
Реагенты могут быть широко применены в различных областях, таких как органическая и неорганическая химия, биология, фармакология, материаловедение и др.
Реагенты часто классифицируются в зависимости от их функции в реакции:
- Исходные реагенты (реагенты-прекурсоры) — это вещества, которые являются начальными материалами в химической реакции. Они могут изменяться или растворяться в процессе реакции, образуя конечные продукты.
- Окислительные реагенты — это реагенты, которые передают электроны другому веществу во время реакции окисления. Они обычно содержат атомы с высоким энергетическим потенциалом, которые могут легко отдать электроны.
- Восстановительные реагенты — это реагенты, которые принимают электроны от другого вещества во время реакции восстановления. Они обычно содержат атомы с низким энергетическим потенциалом, которые могут легко принять электроны.
Другим важным аспектом реагентов является их безопасность и правильное хранение
Многие реагенты являются опасными, токсичными или взрывоопасными, поэтому необходимо соблюдать специальные меры предосторожности при работе с ними. Они должны быть хранены в специальных контейнерах с ярлыками и правильно утилизированы после использования
В заключение, реагенты играют ключевую роль в химических реакциях и исследованиях. Они позволяют проводить синтез, анализ и модификацию веществ, что способствует развитию науки и промышленности.
Реакция нейтрализации
Реакция нейтрализации – это химическая реакция, происходящая между кислотой и основанием, в результате которой образуется соль и вода
Важной особенностью реакции нейтрализации является то, что реагенты, участвующие в реакции, полностью превращаются в продукты, а значит, реакция является полной и обратимой
Основной продукт реакции нейтрализации – соль – обладает определенными свойствами, такими как растворимость в воде и способность проводить электрический ток. Кроме того, при реакции нейтрализации может образовываться и дополнительный продукт – амфотерное соединение, которое может проявлять свойства и кислоты, и основания.
Примером реакции нейтрализации может быть реакция между соляной кислотой и гидроксидом натрия:
- Соляная кислота (HCl) + Гидроксид натрия (NaOH) → Натрий хлорид (NaCl) + Вода (H2O)
В данном случае соляная кислота выступает в роли кислоты, а гидроксид натрия – в роли основания. При их реакции образуется натрий хлорид – соль, и вода. Реакция нейтрализации является экзотермической – при ней выделяется тепло.
Реакция нейтрализации имеет широкое практическое применение. Например, она используется для получения солей, используемых в производстве различных химических веществ. Также реакция нейтрализации применяется в медицине для нейтрализации излишков кислоты в желудке с помощью антацидных препаратов.
| Основные компоненты реакции нейтрализации: | Примеры |
|---|---|
| Кислоты: | Соляная кислота (HCl), уксусная кислота (CH3COOH), серная кислота (H2SO4) |
| Основания: | Гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид аммония (NH4OH) |
| Соли (основная продукт реакции): | Натрий хлорид (NaCl), ацетат натрия (CH3COONa), сульфат натрия (Na2SO4) |
| Вода (вторичный продукт реакции): | H2O |
Реагент — что это?
Реагент – это химическое вещество или смесь веществ, используемых в химической реакции для обнаружения, анализа или изменения других веществ. Реагенты часто используются в лабораторных исследованиях, фармацевтике, медицине и промышленности.
Реагенты используются в различных областях. В медицине они могут служить для диагностики и лечения заболеваний. Лекарственные препараты, такие как антибиотики и витамины, являются примерами реагентов, используемых в медицине.
В химическом анализе реагенты применяются для определения наличия или концентрации определенных веществ. Например, индикаторы, такие как фенолфталеин и бромтимоловый синий, используются для измерения pH растворов.
Реагенты могут быть также использованы для изменения свойств других веществ. Например, кислоты и щелочи могут использоваться для изменения pH раствора, а окислители и восстановители могут использоваться для окисления или восстановления веществ.
Реагенты могут быть представлены в различных формах, таких как порошок, жидкость или газ. Они могут быть одиночными предметами или комбинациями нескольких веществ. Реагенты могут также быть определенными химическими элементами или соединениями. Все это делает реагенты важными ингредиентами в химии и других научных дисциплинах.
Определение реагента в химии
Реагент — это химическое вещество, которое участвует в химической реакции. Реагенты являются основными ингредиентами в химических процессах и могут быть разных типов. Они могут быть элементами, соединениями или компонентами, которые изменяются во время реакции.
Реагенты могут использоваться как в лаборатории, так и в промышленности. В лаборатории реагенты часто используются для проведения различных экспериментов и анализов. В промышленности реагенты могут использоваться для производства различных химических веществ, лекарств, подкрашивания, очистки и других процессов.
Реагенты могут быть в разных формах, например, в виде порошка, жидкости, газа. Кроме того, реагенты могут быть чистыми веществами или смесями различных химических соединений
Некоторые реагенты являются опасными химикатами и требуют специальных мер предосторожности при работе с ними
Важно отметить, что реагенты являются основными активными агентами в химических реакциях. Они могут быть использованы для изменения или превращения других веществ, а также для получения новых продуктов
Благодаря реагентам химики могут изучать и понимать различные процессы и явления в химии, а также применять их в практических целях.
Роли и функции реагента
Реагент — это вещество, которое используется в химической реакции для взаимодействия с другими веществами и изменения их состояния или свойств. Реагенты играют важную роль в различных областях науки и промышленности, включая химию, фармакологию, биологию и материаловедение.
В химии реагенты играют ключевую роль в проведении различных экспериментов и синтезе новых веществ. Они могут быть использованы для активации химических реакций, изменения pH среды, определения содержания определенных ингредиентов или компонентов в реакционной смеси и т. д. Реагенты могут быть органическими или неорганическими веществами, и их выбор зависит от цели и условий проведения эксперимента.
В фармакологии реагенты используются для создания, тестирования и анализа различных лекарственных препаратов. Реагенты могут использоваться для получения активных компонентов лекарственных средств, контроля качества продукции, определения содержания вещества в препарате и т. д. Одним из примеров такого реагента является индикатор, который позволяет определить pH среды и проконтролировать концентрацию препарата.
Реагенты также играют важную роль в биологии, где они используются для исследования биологических процессов и взаимодействий. Они могут быть использованы для определения наличия определенного белка или гена в организме, изменения состояния клеток или тканей, детектирования определенных веществ в биологической среде и т. д. Также в биологии реагенты могут использоваться для проведения различных тестов и экспериментов с целью выявления причин и механизмов развития различных болезней и состояний организма.
Наконец, реагенты играют важную роль в материаловедении и производстве, где они используются для создания и изменения свойств различных материалов и изделий. Реагенты могут быть использованы для осаждения слоев на поверхности материала, определения содержания и состава материала, модификации свойств материала и т. д. Они позволяют улучшить качество и функциональность продукции, а также создать новые материалы с требуемыми свойствами.
Слайд 70 Электронные ресурсы для поиска литературы для рефератов, курсовых,

обладающая богатыми возможностями поиска и получения информации. Для того, чтобы
часть статей открывалась, потребуется регистрация и вход со своего аккаунта. elibrary позволяет скачивание статей только с условием подписки университета, поэтому и использовать этот сайт надо с компьютеров, подключённых к университетской сети.
Академия Гугл — Бесплатная поисковая система по полным текстам научных публикаций всех форматов и дисциплин. В Академии Google очень много ссылок на научные статьи. Ищет статьи как на английском, так и на русском языке, но лучше искать на английском. При нажатии на статью происходит переход на сайт, где эта статья располагается (если она платная), или происходит скачивание текста статьи (если статья бесплатная). Если статья платная, то надо найти и скопировать её DOI (цифровой идентификатор объекта) — это набор цифр и букв, который является уникальным для каждой статьи. DOI можно ввести на сайте Sci-hub (см. ниже) и открыть полный текст статьи, который можно будет сохранить на жёсткий диск. Академию Google можно использовать на любом компьютере.
Положения теории Бутлерова
Органическая и неорганическая химии не имеют строгой разграниченности. Принято считать, что органическая химия изучает структуры на основе углерода в четырехвалентном состоянии и водорода. Однако для того чтобы такое утверждение считать удовлетворительным, необходимо сделать целый ряд уточнений и дополнений.
Положения теории строения химических веществ А. М. Бутлерова заключаются в следующем:
1.Атомы соединены друг с другом в определенной последовательности в молекулах в соответствии с их валентностями. Химическим строением называется последовательность межатомных связей в молекуле. Она выражается конкретной структурной формулой.
2.Химическое строение может быть установлено химическими методами (в настоящее время используются также современные физические методы).
3.Свойства всех веществ диктуются их химическим строением.
4.Строение молекулы можно узнать по свойствам данного вещества так же, как и по строению, можно предвидеть свойства данного вещества.
5.Атомы и группы атомов (функциональные группы) в молекуле всегда оказывают взаимное влияние, что также отражается на их свойствах.
Теория Бутлерова является основой органической химии и послужила толчком к быстрому ее развитию. Основываясь на положениях теории, Бутлеров объяснил явление изомерии, предсказал существование изомеров и синтезировал некоторые из них.
В основе углеродного скелета лежит углерод с валентностью четыре, находящийся в одном из возможных гибридных состояний – sp-, sp2-, sp3-гибридизации. Рассматривая строение атома углерода и образованные им связи, мы опираемся на возбужденное состояние внешних электронных подуровней углерода:
| ↑ | ↑ | ↑ | ↑ | |
| 2s | 2p |
Как можно видеть, углерод находится в возбужденном состоянии и имеет четыре неспаренных электрона на внешнем энергетическом уровне. Возбужденное состояние при перескоке электрона с 2s- на 2p-электронный подуровень происходит достаточно легко, поэтому углерод чаще всего как в органических, так и в неорганических соединениях находится именно в этом состоянии.
Чтобы определить, в каком именно гибридизованном состоянии находится конкретный атом углерода в соединении, необходимо произвести анализ количества π- и σ-связей. При образовании четырех равноценных σ-связей между рассматриваемым атомом углерода и другими атомами молекулы в гибридизации участвуют все четыре электрона, образуются новые – гибридные. Такой тип гибридизации называется sp3-гибридизация. При этом происходит усреднение как пространственных, так и энергетических характеристик 2s- и 2p-энергетического подуровней и отдельно взятых орбиталей в их составе (рис. 1).
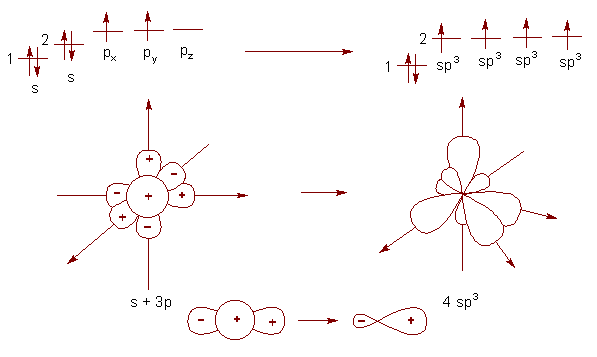
Рис. 1. Sp3-гибридизация валентных орбиталей атома углерода
Тетраэдрическое расположение облаков, все углы между облаками – 109°28´.
В случае образования трех σ-связей и одной π-связи (присутствует одна ) не все валентные электроны участвуют в гибридизации. Для образования полноценной π-связи необходимо наличие p- или d-орбитали в неизмененном, симметрично вытянутом относительно узла между облаками, состоянии . Происходит sp2-гибридизация. Выравнивание по энергии и форме происходит только между s-орбиталью и двумя p-орбиталями (рис. 2).
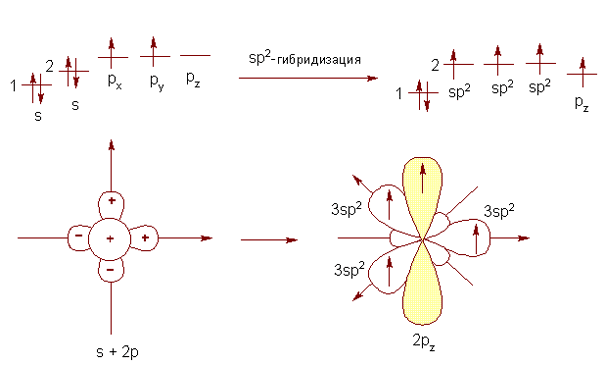
Рис. 2. Sp2-гибридизация валентных орбиталей атома углерода
Гибридизованные орбитали образуют плоский равносторонний треугольник. Углы между ними составляют 120°, негибридизованное облако располагается перпендикулярно этому треугольнику, проходя через его центр.
В случае образования двух π- и двух σ-связей (две двойные связи либо тройная и одинарная связи от одного атома углерода) происходит гибридизация только s-орбитали и одной р-орбитали. Оставшиеся две орбитали не претерпевают гибридизацию для обеспечения двух π-связей (рис. 3).
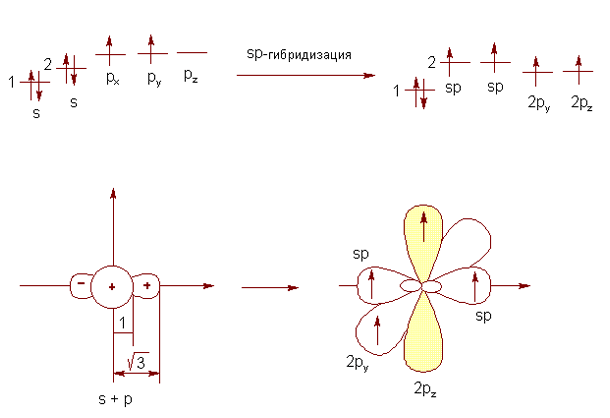
Рис. 3. Sp-гибридизация валентных орбиталей атома углерода
Гибридизованные облака располагаются под углом 180° друг к другу. Перпендикулярно им и друг другу располагаются две негибридизованных р-орбитали. Во всех трех случаях именно такое пространственное расположение соответствует минимальному отталкиванию между орбиталями, а также наиболее стабильному, уравновешенному состоянию
Важно отметить, что при образовании одинарной σ-связи возможно вращение вокруг нее, в то время как кратные за счет именно π-связи в их составе не позволяют осуществлять вращение (далее будет рассмотрен этот тип вращения, имеющий название – конформационное)
В: Что произойдет, если у меня недостаточно лимитирующих реагентов?
Если в данной реакционной смеси присутствует недостаточное количество предельно-реактивного вещества и происходит неполная конверсия, это снизит конечный выход (а также приведет к потере любого дополнительного не ограничивающего вещества). В редких случаях это может вызвать образование нежелательных побочных продуктов и затруднить восстановление/разделение этапов после завершения в зависимости от конкретных задействованных систем, таких как установки органического синтеза, где усилия по очистке могут быстро стать дорогими/непрактичными, когда выходы и чистота не соответствуют требованиям. заранее правильно оптимизирован.
Электронные эффекты
Электронные эффекты – смещение электронной плотности в молекуле, ионе или радикале под влиянием заместителей.
Заместителями являются любые атомы (кроме водорода) или группы атомов, связанные с данным атомом углерода.
Различают (I) и (M) эффекты заместителей.
Индуктивный эффект (I-эффект)
Полярная ковалентная связь – это связь между атомами с различной электроотрицательностью. Наличие в молекуле полярной s-связи содействует поляризации ближайших нескольких s-связей, что приводит к возникновению частичных положительных или отрицательных зарядов (δ+ или δ–) на соседних атомах. Смещение электронной плотности всех s-связей обозначается прямыми стрелками (по линии связи) и символами частичных зарядов, индуцируемых заместителем.
То есть заместители (X или Y) вызывают поляризацию и своей, и соседних связей. Этот вид передачи влияния атомов, приводящий к поляризации ковалентных связей и образованию зарядов на атомах, называется индукционным электронным эффектом. Индуктивный эффект – это смещение электронной плотности вдоль цепи s-связей, в результате различия в электроотрицательностях атомов . По причине слабой поляризуемости s-связей I-эффект быстро уменьшается при удалении от заместителя и через 3–4 связи практически исчезает. Индуктивный эффект является отрицательным (–I), когда заместитель уменьшает электронную плотность на углероде, с которым связан этот заместитель. В этом случае заместитель приобретает частичный отрицательный заряд (d-), а атом углерода приобретает частичный положительный заряд (δ+). Если заместитель увеличивает электронную плотность на атоме углерода, то индуктивный эффект называется положительным (+I), так как индуцируя на нем частичный отрицательный заряд δ-, сам он приобретает заряд δ+.
Атомом водорода, индуктивный эффект которого принят за 0, является ориентиром направления (знака) I-эффекта заместителя.
–I-эффект проявляют заместители, которые содержат более электроотрицательные атомы, чем атом углерода:
–OH, –F, –Cl, –Br, >C=O, –COOH, –NH2, –NO2 и др.
+I-эффектом обладают заместители, имеющие атомы с низкой электроотрицательностью:
–Li, –Mg–; алифатические углеводородные радикалы (–CH3, –C2H5) и т. п.
Мезомерный эффект (М-эффект)
Смещение электронной плотности по цепи делокализованных (сопряженных) p-связей называют мезомерным эффектом. Такой эффект соответствует заместителям, связанным с sp2- или sp-гибридизованными атомами. Из-за высокой подвижности p-электронов М-эффект без затухания передается по цепи сопряжения. +М-эффект имеет заместители, увеличивающие электронную плотность в сопряженных системах. Таковыми являются группы, содержащие атомы с неподеленной парой электронов, и способные передавать эту пару электронов в общую систему сопряжения. +М-эффект характерен для групп –OH и –NH2, например, в молекуле фенола C6H5OH группа –OH проявляет +М-эффект за счет участия одной из неподеленных электронных пар атома кислорода в системе сопряжения. –М-эффект характерен для заместителей с электроотрицательными атомами, которые смещают электронную плотность в свою сторону. –М-эффект характерен для групп –CH=O, –NO2, –COOH. Несмотря на то, что в этих группах есть неподеленные электронные пары, пространственное расположение их орбиталей с этими электронами не позволяет им участвовать в системе сопряжения. Получается, что заместитель может лишь оттягивать электроны из системы сопряжения из-за своей высокой электроотрицательности. Для определения знака М-эффекта строят атомно-орбитальные модели, показывающие пространственную ориентацию орбиталей, а также возможность их перекрывания.
Органические субстраты: структура и реакционная способность
Органические субстраты — это химические соединения, которые служат исходными материалами для различных химических реакций. Они могут быть использованы в химической синтезе для получения новых соединений или как реагенты в реакциях превращения уже имеющихся соединений.
Структура органических субстратов определяет их реакционную способность. Основные факторы, которые влияют на реакционную способность органических субстратов, включают:
- Функциональные группы: различные функциональные группы (например, гидроксильные, карбоксильные, аминовые группы) присутствующие в органических субстратах, имеют различные химические свойства и могут вступать в определенные типы реакций. Наличие определенной функциональной группы может определять специфичность реакции.
- Реакционный центр: это атом или группа атомов в органическом субстрате, где происходит химическая реакция. Реакционный центр может быть связан с функциональной группой и играть роль активной точки для реагентов.
- Размер и форма молекулы: молекулярный размер и форма органических субстратов могут влиять на доступность реакционных центров для реагентов. Большие и сложные молекулы могут ограничивать доступ к реакционным центрам и замедлять химические превращения.
Органические субстраты широко используются в органической химии и имеют множество применений в различных областях, включая фармацевтическую промышленность, производство пластиков, производство красителей и многое другое. Их структура и реакционная способность являются основными параметрами при проектировании и совершенствовании главнейших методов органического синтеза.
Слайд 41 Ретросинтетический анализ“При решении подобных задач очень важно уметь

развить, но теперь почему-то мало этим занимаются. В повседневной жизни
гораздо полезнее думать наперед, поэтому рассуждения обратным ходом сейчас не в почёте. Из пятидесяти человек лишь один умеет рассуждать аналитически, остальные же мыслят только синтетически.” Шерлок Холмс в Этюде в багровых тонах.
“Ретросинтетический анализ — методика превращения (трансформации) структуры целевой молекулы (TM) в последовательность упрощающихся структур, которая в конечном счете приводит к простым или коммерчески доступных исходным веществам для химического синтеза.”
1990 г. – Элайас Кори. Нобелевская премия по химии. «За развитие теории и методологии органического синтеза». (в особенности за ретросинтетический анализ)
Слайд 72 Другой ресурс для поиска и скачивания статей на

текстам статей. Работает без подписки, т.е пользоваться сайтом можно и
не в университете. Для бесплатного скачивания иностранных статей есть хороший сайт – Researchgate.
https://www.researchgate.net/В 2009 году ResearchGate дал возможность загружать недавно опубликованные статьи с соблюдением авторских прав. Пользователи могут читать и скачивать статьи бесплатно. К сожалению, основным недостатком сайта является то, что часть статей скачивается только после регистрации, для которой необходимо использовать электронную почту университета (личная почта не подойдет!).






























