приложений
Атомная единица массы
Средняя атомная масса 12C используется в качестве стандартной меры для расчета массы других элементов. Таким образом, водород весит двенадцатую часть этого изотопа углерода, который используется для определения того, что известно как атомная единица массы u.
Таким образом, другие атомные массы можно сравнить с 12С а 1H. Например, магний (24Mg) весит примерно вдвое больше, чем атом углерода, и в 24 раза больше, чем атом водорода.
Углеродный цикл и жизнь
Растения поглощают СО2 в процессе фотосинтеза выделяют кислород в атмосферу и действуют как легкие растений. Когда они умирают, они становятся древесным углем, который после сжигания выделяет СО2. Одна часть возвращается к растениям, а другая попадает в морское дно, питая многие микроорганизмы.
Когда микроорганизмы умирают, оставшиеся твердые в его осадок биологического разложения, и через миллионы лет, он превращается в то, что известно как нефть.
Когда человечество использует это масло в качестве альтернативного источника энергии для сжигания угля, оно способствует выделению большего количества СО2 (и другие нежелательные газы).
С другой стороны, жизнь использует атомы углерода из самых глубоких ее основ. Это происходит из-за стабильности его связей, что позволяет ему формировать цепочки и молекулярные структуры, которые составляют макромолекулы, столь же важные, как ДНК.
ЯМР спектроскопия 13С
13С, даже если он в гораздо меньшей пропорции, чем 12С его обилие достаточно, чтобы выяснить молекулярные структуры с помощью ядерной магнитно-резонансной спектроскопии углерода-13.
Благодаря этой методике анализа можно определить, какие атомы окружают 13С и к каким функциональным группам они относятся. Таким образом, углеродный скелет любого органического соединения может быть определен.
Гибридизация
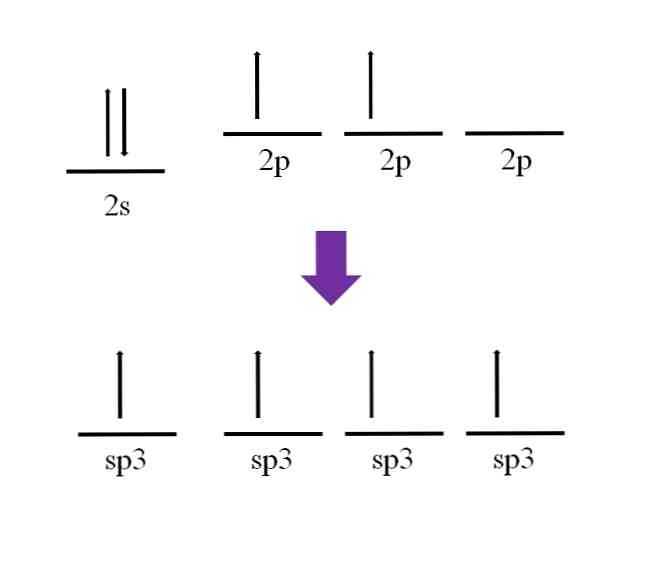
Ранее упоминалось, что атом углерода четырехвалентен. Согласно его электронной конфигурации, его 2s-электроны спарены, а 2p — неспарены:
Имеется одна доступная p-орбиталь, которая пуста и заполнена дополнительным электроном на атоме азота (2p3).
Согласно определению ковалентной связи, необходимо, чтобы каждый атом вносил электрон для ее образования; однако видно, что в исходное состояние атома углерода у него есть только два неспаренных электрона (по одному на каждой 2p-орбитали). Это означает, что в этом состоянии это двухвалентный атом, а значит, он образует только две связи (–C–).
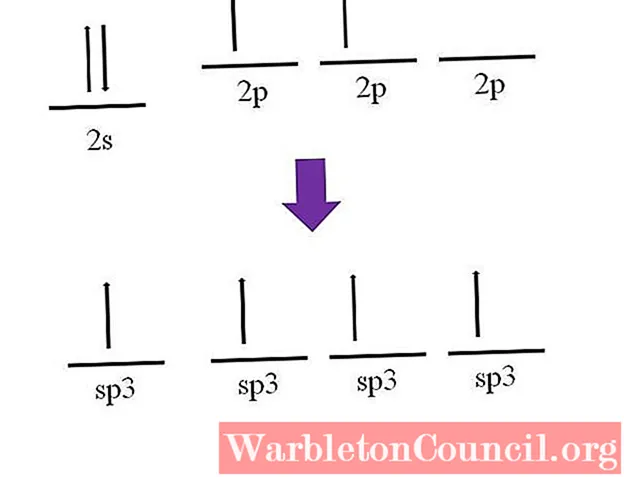
Итак, как атом углерода может образовывать четыре связи? Для этого вы должны переместить электрон с орбитали 2s на орбиталь 2p с более высокой энергией
Это сделано, в результате четыре орбитали выродиться; другими словами, они имеют одинаковую энергию или стабильность (обратите внимание, что они выровнены)
Этот процесс известен как гибридизация, и благодаря ему атом углерода теперь имеет четыре sp-орбитали.3 с одним электроном каждый, чтобы сформировать четыре связи. Это связано с его четырехвалентностью.
Характеристики атома углерода
Атом углерода обозначается буквой C. Его атомный номер Z равен 6, следовательно, он имеет шесть протонов (красные кружки с символом «+» в ядре). Кроме того, он имеет шесть нейтронов (желтые кружки с буквой «N») и, наконец, шесть электронов (голубые звезды).
Сумма масс их атомных частиц дает среднее значение 12.0107 ед. Однако атом на изображении соответствует 12-изотопу углерода (12В), который состоит из д. Другие изотопы, такие как 13С и 14С, менее обильные, изменяются только по числу нейтронов.
Итак, если вы рисуете эти изотопы на 13C будет иметь дополнительный желтый круг, а 14С, еще два. Это логически означает, что они являются более тяжелыми атомами углерода.
В дополнение к этому, какие еще характеристики могут быть упомянуты в этом отношении? Он четырехвалентен, то есть может образовывать четыре ковалентные связи. Он расположен в группе 14 (НДС) периодической таблицы, более конкретно в блоке p.
Это также очень универсальный атом, способный связывать практически все элементы периодической таблицы; особенно с самим собой, образуя макромолекулы и линейные, разветвленные и пластинчатые полимеры.
Азотсодержащие органические вещества
Азотсодержащие вещества можно также разделить на классы по наличию определенных функциональных групп.
- амины – содержат группы –NН2, –NH–, либо -N< ,
- нитрилы (группа –СºN),
- азотистые гетероциклы.
Некоторые органические вещества содержат и азот, и кислород.
К ним относятся:
- нитросоединения –NO2
- амиды –CONH2,
- аминокислоты – полифункциональные соединения, которые содержат и карбоксильную группу –COOH, и аминогруппу –NH2
| Азотсодержащие вещества | |||||
| Амины | Нитрилы | Нитросоединения | Амиды | Аминокислоты | Гетероциклы |
|
-NH2
-NH- -N< |
-C≡N | R-NO2 | R-C(NH2)=O | -NH2, -COOH | |
|
Метиламин
CH3-NH2 |
Нитрил уксусной кислоты
CH3-C≡N |
Нитрометан
CH3-NO2 |
Амид уксусной кислоты
CH3-C(NH2)=O |
Аминоуксусная кислота
CH2(NH2)-COOH |
Пиррол |
Реакции разложения
2.1. Дегидрирование и дегидроциклизация
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
CnH2n+2 → CnH2n-х + (х+1)H2
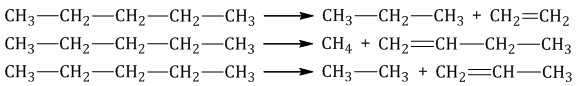
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
| Например, при дегидрировании этана образуются этилен или ацетилен: |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
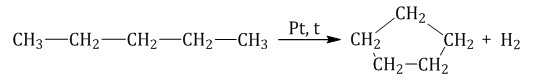
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
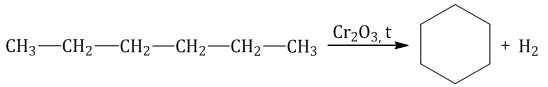
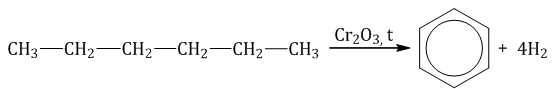
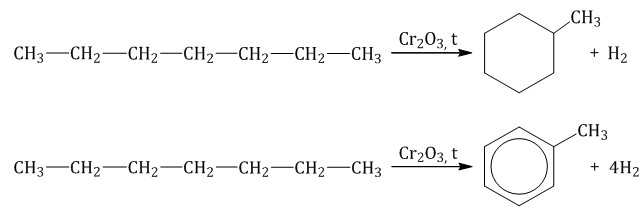
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
2.2. Пиролиз (дегидрирование) метана
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы с более короткой углеродной цепью и алкены.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
|
Например, при крекинге н-пентана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды.
|
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
Физические свойства алканов
Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах «газа», определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку). Углеводороды состава от С5Н12 до С15Н32 — жидкости; более тяжелые углеводороды — твердые вещества. Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Другие органические вещества
Органические соединения очень многочисленны и разнообразны.
К важным классам органических соединений также относятся галогенопроизводные органические вещества R–Hal ,которые содержат также атомы галогенов (хлора, фтора, брома и др.).
В состав органических соединений также могут входить несколько одинаковых или различных функциональных групп.
Гомологи. Гомологический ряд
Органические вещества разных классов тесно взаимосвязаны.
Соединения, содержащие одинаковые функциональные свойства, проявляют схожие химические и физические свойства.
| Вещества, которые содержат одинаковые функциональные группы, имеют сходное строение, но отличаются друг от друга на одну или несколько групп –СH2–, образуют гомологический ряд. |
| Гомологи – это вещества, которые входят в один и тот же гомологический ряд. |
Группу –СH2– называют гомологической разностью.
| Например, 2-метилбутан и 2-метилпентан являются гомологами: | |
гибридизация
Ранее упоминалось, что атом углерода является четырехвалентным. В соответствии с его электронной конфигурацией его 2s-электроны спарены, а 2p-электроны спарены:
Остается свободная орбиталь, которая пуста и заполнена дополнительным электроном в атоме азота (2р3).
Согласно определению ковалентной связи, необходимо, чтобы каждый атом вносил электрон для своего образования; Тем не менее, можно заметить, что в базальное состояние атома углерода, он едва имеет два неспаренных электрона (по одному в каждой 2p-орбитали). Это означает, что в этом состоянии это двухвалентный атом, и, следовательно, он образует только две связи (-C-).
Итак, как это возможно, что атом углерода образует четыре связи? Для этого вы должны продвинуть электрон с орбитали 2s на орбиту с более высокой энергией 2p
Это сделано, четыре получающиеся орбитали вырождаться; другими словами, они имеют одинаковую энергию или стабильность (обратите внимание, что они выровнены)
Этот процесс известен как гибридизация, и благодаря этому теперь атом углерода имеет четыре орбитальных sp3 с одним электроном каждый, чтобы сформировать четыре связи. Это связано с тем, что он является четырехвалентным.
зр3
Когда атом углерода обладает sp-гибридизацией3, Ориентируйте его четыре гибридные орбитали к вершинам тетраэдра, который является его электронной геометрией.
Таким образом, вы можете определить углеродный сп3 потому что он образует только четыре простые связи, как в молекуле метана (СН4). И вокруг этого можно наблюдать тетраэдрическую среду.
Перекрытие sp орбиталей3 она настолько эффективна и стабильна, что простая связь C-C имеет энтальпию 345,6 кДж / моль. Это объясняет, почему существуют бесконечные углеродистые структуры и неизмеримое количество органических соединений. В дополнение к этому, атомы углерода могут образовывать другие типы связей.
зр2 и зр
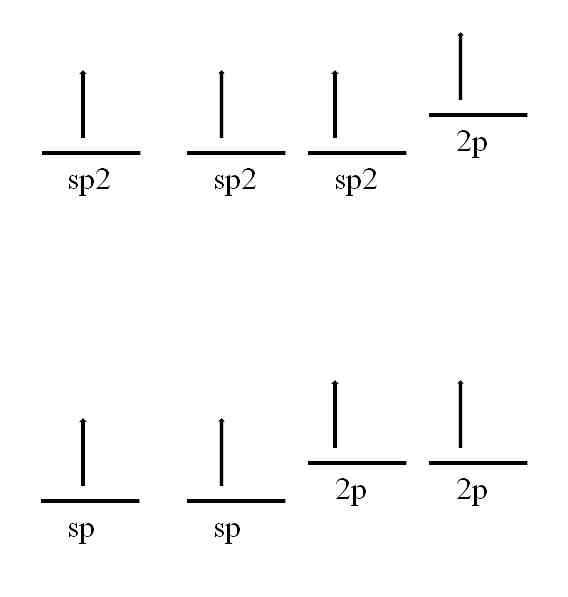
Атом углерода также способен принимать другие гибридизации, которые позволят ему образовывать двойную или даже тройную связь.
В sp гибридизации2, Как видно на изображении, есть три sp-орбитали2 вырождается и 2p орбиталь остается неизменной или «чистой». С тремя орбитали2 отделенный на 120º, углерод образует три ковалентные связи, рисуя электронную геометрию в треугольной плоскости; в то время как с 2p-орбиталью, перпендикулярной остальным трем, она образует связь π: -C = C-.
Для случая sp-гибридизации есть две sp-орбитали, разделенные на 180º, так что они рисуют линейную электронную геометрию. На этот раз они имеют две чистые 2p-орбитали, перпендикулярные друг другу, которые позволяют углероду образовывать тройные связи или две двойные связи: -C≡C- или … C = C = C … (центральный углерод имеет sp-гибридизацию) ).
Обратите внимание, что всегда (обычно), если вы добавите ссылки вокруг углерода, вы обнаружите, что число равно четырем. Эта информация важна при рисовании структур Льюиса или молекулярных структур
Атом углерода, образующий пять связей (= C≡C), теоретически и экспериментально недопустим.
Номенклатура органических соединений
Рекомендуем посмотреть наш гайд по названию органических веществ!
В начале развития органической химии открываемым соединениям присваивались тривиальные названия, часто связанные с историей их получения: уксусная кислота (являющаяся основой винного уксуса), масляная кислота (образующаяся в сливочном масле), гликоль (т. е. «сладкий») и т. д. По мере увеличения числа новых открытых веществ возникла необходимость связывать названия с их строением. Так появились рациональные названия: метиламин, диэтиламин, этиловый спирт, метилэтилкетон, в основе которых лежит название простейшего соединения. Для более сложных соединений рациональная номенклатура непригодна.
Теория строения А. М. Бутлерова дала основу для классификации и номенклатуры органических соединений по структурным элементам и по расположению атомов углерода в молекуле. В настоящее время наиболее употребляемой является номенклатура, разработанная Международным союзом теоретической и прикладной химии (IUPAC), которая называется номенклатурой ИЮПАК. Правила ИЮПАК рекомендуют для образования названий несколько принципов, один из них — принцип замещения. На основе этого разработана заместительная номенклатура, которая является наиболее универсальной. Приведем несколько основных правил заместительной номенклатуры и рассмотрим их применение на примере гетерофункционального соединения, содержащего две функциональные группы, — аминокислоты лейцина:
1. В основе названия соединений лежит родоначальная структура (главная цепь ациклической молекулы, карбоциклическая или гетероциклическая система). Название родоначальной структуры составляет основу названия, корень слова.
В данном случае родоначальной структурой является цепь из пяти атомов углерода, связанных одинарными связями. Таким образом, коренная часть названия — пентан.
2. Характеристические группы и заместители (структурные элементы) обозначаются префиксами и суффиксами. Характеристические группы подразделяются по старшинству. Порядок старшинства основных групп:
Выявляют старшую характеристическую группу, которую обозначают в суффиксе. Все остальные заместители называют в префиксе в алфавитном порядке.
В данном случае старшей характеристической группой является карбоксильная, т. е. это соединение относится к классу карбоновых кислот, поэтому к коренной части названия добавляем -овая кислота. Второй по старшинству группой является аминогруппа, которая обозначается префиксом амино-. Кроме этого, молекула содержит углеводородный заместитель метил-. Таким образом, основой названия является аминометилпентановая кислота.
3. В название включают обозначение двойной и тройной связи, которое идет сразу после корня.
Рассматриваемое соединение не содержит кратных связей.
4. Атомы родоначальной структуры нумеруют. Нумерацию начинают с того конца углеродной цепи, к которому ближе расположена старшая характеристическая группа:
Нумерацию цепи начинают с атома углерода, входящего в состав карбоксильной группы, ему присваивается номер 1. В этом случае аминогруппа окажется при углероде 2, а метил — при углероде 4.
Таким образом, природная аминокислота лейцин по правилам номенклатуры ИЮПАК называется 2-амино-4-метилпентановая кислота.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия)
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла.
Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Классификация органических соединений
Классификацию органических веществ определяют строение углеродной цепи (углеродного скелета) и наличие и особенности строения функциональных групп.
| Углеродный скелет – это последовательность соединенных между собой атомов углерода в органической молекуле. |
| Функциональная группа – это атом или группа атомов, которая определяет принадлежность молекулы к определенному классу органических веществ и химические свойства, соответствующие данному классу веществ. |
|
Классификация органических веществ по составу |
||
| Углеводороды | Кислородсодержащие вещества | Азотсодержащие вещества |
| Состоят из атомов углерода и водорода | Содержат также атомы кислорода | Содержат также атомы азота |
Классификация органических веществ
Известно, что свойства органических веществ определяются их составом и химическим строением. Поэтому неудивительно, что в основе классификации органических соединений лежит именно теория строения — теория А. М. Бутлерова. Классифицируют органические вещества по наличию и порядку соединения атомов в их молекулах. Наиболее прочной и малоизменяемой частью молекулы органического вещества является ее скелет — цепь атомов углерода. В зависимости от порядка соединения атомов углерода в этой цепи вещества делятся на ациклические, не содержащие замкнутых цепей атомов углерода в молекулах, и карбоциклические, содержащие такие цепи (циклы) в молекулах.
Помимо атомов углерода и водорода молекулы органических веществ могут содержать атомы и других химических элементов. Вещества, в молекулах которых эти так называемые гетероатомы включены в замкнутую цепь, относят к гетероциклическим соединениям.
Гетероатомы (кислород, азот и др.) могут входить в состав молекул и ациклических соединений, образуя в них функциональные группы, например,
гидроксильную
,
карбонильную
,
карбоксильную
,
аминогруппу
.
Функциональная группа — группа атомов, которая определяет наиболее характерные химические свойства вещества и его принадлежность к определенному классу соединений.
АЛКАНЫ
Общая характеристика
 |
Атомы
углерода находятся в первом валентном состоянии (sp3 – гибридизация). С – скелеты алканов имеют
зигзагообразную форму, т.е. “изломаны” в пространстве под валентными
тетраэдрическими углами 10928’.
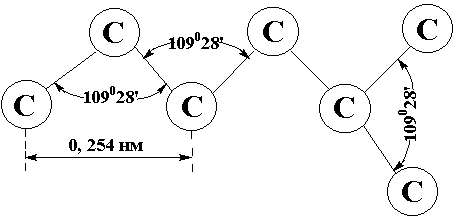 |
Модель структуры углеродного
скелета алкана.
Атомы
(С – С) и (С – Н) соединены одинарными связями.
Простейшим
представителем алканов является метан СН4 ( структуру молекулы
метана см. рис. 10). Он является “родоначальником” гомологического ряда
метана (ГРМ) — серии сходных по свойствам однотипных соединений
имеющих общую формулу СnH2n+2.
Гомологи
(члены данного класса органических соединений) отличаются друг от
друга по составу на одну или несколько групп атомов СН2,
называемой гомологической разностью.
Учение о гомологии значительно упростило изучение
органической химии. Гомологи – соединения с однотипной структурой, близкими и
закономерно изменяющимися химическими и физическими свойствами. Изучение
свойств небольшого числа гомологов позволяет делать вывод о свойствах большого
числа других членов гомологического ряда.
Для
наименования алканов используются греческие числительные
|
1 – моно |
5 — пента |
9 – нона |
|
2 – ди |
6 – гекса |
10 – дека |
|
3 – три |
7 – гепта |
11 – ундека |
|
4 — тетра |
8 — окта |
12 — додека |
Названия
алканов образуются от корня названия цифры с добавлением суффикса “ан”: 5 –
пента, С5Н12 – пентан; 8 – окта, С8Н18 —
октан и т.д.
Исключение – тривиальные названия первых четырех
гомологов
1 — метан, 2 — этан, 3 — пропан, 4 — бутан.
Названия
алканов по греческим числительным начинаются с пентана.
Изомерия алканов
В зависимости от положения в цепи атом углерода может
быть
первичный
(I) -(связан
с одним С, “концевой”),
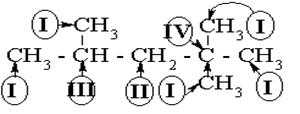 |
вторичный (II)
третичный (III)
(связан с тремя С) и
четвертичный (IV) (связан с четырьмя
С):
Гомологический ряд алканов (СnH2n+2) с нормальной (неразветвленной)
С – цепью
|
n |
Название |
Формула |
Т.пл., С |
Т.кип., С |
Плотн. r, г/см3 |
Возможн. Число изомеров |
|
1 2 3 4 |
Метан Этан Пропан Бутан |
СН4 СН3 – СН3 СН3 – СН2 СН3 – (СН2)2 |
-183 -172 -188 -155 |
-161 -89 -42 -0,5 |
0,424 0,546 0,584 0,600 |
1 1 1 2 |
|
5 6 7 |
Пентан Гексан Гептан |
СН3 – (СН2)3 СН3 – (СН2)4 СН3 – (СН2)5 |
-130 -95 -91 |
36,1 68,7 98,4 |
0,625 0,659 0,684 |
3 5 9 |
|
8 9 10 |
Октан Нонан Декан |
СН3 – (СН2)6 СН3 – (СН2)7 СН3 – (СН2)8 |
-57 -54 -30 |
126 151 174 |
0,703 0,718 0,730 |
18 35 75 |
|
15 |
СН3 – (СН2)13 |
+10 |
+270 |
0,749 |
4347 |
|
|
20 |
Эйкозан |
СН3 – (СН2)18 |
+37 |
+343 |
0,786 |
366319 |
Атомы
водорода, связанные с этими углеродами, тоже называются первичные, вторичные
и третичные (четвертичных – нет).
Углеводороды нормального (неразветвленного) строения
содержат только первичные и вторичные углероды. Разветвленные – как минимум
один третичный или четвертичный углерод. Возможность изомерии алканов
появляется начиная с бутана (n=4).
С
увеличением n количество возможных изомеров очень быстро
возрастает.
Изомеры
углеводородов отличаются друг от друга количеством и местом положения третичных
и четвертичных углеродов в С – цепи.
Углеводородные радикалы (алкилы)
Для
наименования алканов с разветвленной структурой используют названия замещающих
групп – радикалов, — частей молекул углеводородов, условно (мысленно)
выделенных отнятием одного* атома водорода. Название радикала образуется
от названия алкана путем замены суффикса ”ан” на суффикс “ил”.
Общее название одновалентных радикалов — алкилы; условное
их обозначение – R.
Кроме
количества атомов углерода, алкилы (начиная с пропилов) могут “различаться
положением свободной валентности” у первичного, вторичного или третичного
атомов углерода.
Нахождение в природе и получение
Основные источники алканов – нефть и природный газ.


Метан составляет основную массу природного газа, в нем присутствуют также в небольших количествах этан, пропан и бутан. Метан содержится в выделениях болот и угольных пластов. Наряду с легкими гомологами метан присутствует в попутных нефтяных газах. Эти газы растворены в нефти под давлением и находятся также над ней. Алканы составляют значительную часть продуктов переработки нефти. Содержатся в нефти и циклоалканы – они называются нафтенами (от греч. naphtha – нефть). В природе широко распространены также газовые гидраты алканов, в основном метана, они залегают в осадочных породах на материках и на дне океанов. Их запасы, вероятно, превышают известные запасы природного газа и в будущем могут случить источником метана и его ближайших гомологов. Алканы получают и пиролизом (коксованием) каменного угля и его гидрирования (получение синтетического жидкого топлива). Твердые алканы встречаются в природе в виде залежей горного воска – озокерита, в восковых покрытиях листьев, цветов и семян растений, входят в состав пчелиного воска.

В промышленности алканы получают каталитическим гидрированием оксидов углерода СО
Горный воск
и СО2 (метод Фишера – Тропша). В лаборатории метан можно получить нагреванием ацетата натрия с твердой щелочью: CH3COONa + NaOH → CH4 + Na2CO3, а также гидролизом некоторых карбидов: Al4C3 + 12H2O→ 3CH4 + 4Al(OH)3. Гомологи метана можно получить по реакции Вюрца, например: 2CH3Br + 2Na→CH3–CH3 + 2NaBr. В случае дигалогеналканов получаются циклоалканы, например: Br–CH2–(CH2)4–CH2Br + 2Na→цикло-C6H12 + 2NaBr. Алканы образуются также при декарбоксилировании карбоновых кислот и при электролизе их.
Реакции окисления алканов
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
2C3H8 + 7O2 → 6CO + 8H2O
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление
Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
![]()
При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:
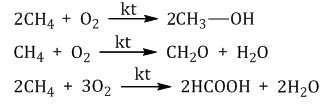
Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре
Продукт реакции – так называемый «синтез-газ».
Спирты и фенолы
Спирты – производные углеводородов, один или несколько атомов водорода в которых заменены на гидроксильную группу -OH. Спирты с одной гидроксильной группой называют одноатомными, с двумя – двухатомными, с тремя трехатомными и т.д. Например:
Спирты с двумя и более гидроксильными группами называют также многоатомными спиртами. Общая формула предельных одноатомных спиртов CnH2n+1OH или CnH2n+2O. Общая формула предельных многоатомных спиртов CnH2n+2Ox , где x – атомность спирта.
Спирты могут быть и ароматическими. Например:
бензиловый спирт
Общая формула таких одноатомных ароматических спиртов CnH2n-6O.
Однако, следует четко понимать, что производные ароматических углеводородов, в которых на гидроксильные группы заменены один или несколько атомов водорода при ароматическом ядре не относятся к спиртам. Их относят к классу фенолы. Например, это данное соединение является спиртом:
А это представляет собой фенол:
Причина, по которой фенолы не относят к спиртам, кроется в их специфических химических свойствах, сильно отличающих их от спиртов. Как легко заметить, однотомные фенолы изомерны одноатомным ароматическим спиртам, т.е. тоже имеют общую молекулярную формулу CnH2n-6O.
Химические свойства алканов
Реакции замещения. Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу. Приведем уравнения характерных реакций галогенирования (которые протекают при освещении или нагревании):
Реакция дегидрирования (отщепления водорода)2323Реакции, сопровождающиеся разрушением углеродной цепи.Горение предельных углеводородов
2. Термическое расщепление углеводородов.
3. Пиролиз. При нагревании метана до температуры 1000 °С начинается пиролиз метана — разложение на простые вещества:
ИзомеризацияАроматизация
3
Оптическая изомерия
Если атом углерода в молекуле связан с четырьмя различными заместителями (атомами или атомными группами), например:
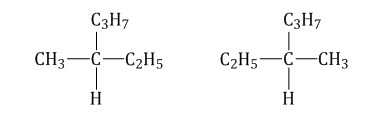
то возможно существование двух соединений с одинаковой структурой, но различным пространственным строением.Молекулы таких соединений относятся друг к другу, как зеркальные изображение и предмет. При этом никаким вращением нельзя получить одну молекулу из другой.
Номенклатура алканов
В названиях алканов используется суффикс -АН.
| Например, алкан имеет название 2-метилпропан. |
Для простейших алканов (метан, этан, пропан, бутан и изобутан) используют тривиальные названия. Начиная с пятиатомного углероводорода, в названии неразветвленных (нормальных) алканов используют корень, который показывает число атомов углерода в молекуле, и добавляют соответствующий суффикс (для алканов – ан, для алкенов – ен, и т.д.).
Название разветвленных алканов строится по следующим правилам:
1. Выбирают главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями. При этом главная цепь должна быть самой длинной. Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а:
| а | б |
Главная цепь должна быть самой разветвленной.
Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от цепи на рисунке б – только один:
| а | б |
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Например, 2-метилпропан:
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 2,2-диметилпропан или 2,2,3-триметилпентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 2,2-диметил-3-этилпентан.
5. Называют главную углеродную цепь, т.е. соответствующий нормальный алкан.
Например, название молекулы на рисунке:
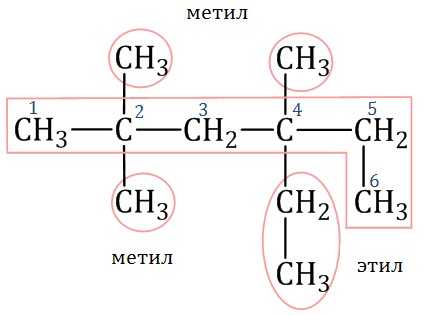
2,2,4-триметил-4-этилгексан
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
Электролиз солей карбоновых кислот (электролиз по Кольбе)
Это электролиз водных растворов солей карбоновых кислот.
В общем виде:
2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R
В водном растворе ацетат натрия практически полностью диссоциирует:
CH3COONa → CH3COO– + Na+
При этом на катод притягиваются катионы натрия Na+ и молекулы воды H2O.
Разряжаться на катоде будут молекулы воды:
Kатод(-): 2H2O + 2e = H2 + 2OH–
На аноде окисляются ацетат-ионы, а именно, атом углерода карбоксильной группы.
При этом от карбоксильной группы отрывается углекислый газ и остаются метильные радикалы, которые образуют газообразный этан:
Aнод(+): 2CH3COO– – 2e = 2CO2 + CH3–CH3
Суммарное уравнение электролиза водного раствора ацетата натрия:
2CH3COONa + 2H2O = H2 + 2NaOH + 2CO2 + CH3–CH3