Мышьяк
А. К 0,3 мл раствора соли мышьяка(III) (около 30 мг арсенит-иона) прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 % и две капли натрия сульфида раствора 2 %; образуется желтый осадок, нерастворимый в хлористоводородной кислоте концентрированной, растворимый в аммиака растворе 10 %.
Б. К 0,3 мл раствора соли мышьяка(III) (около 3 мг арсенит-иона) прибавляют 1 – 2 капли серебра нитрата раствора 2 %; образуется желтый осадок, растворимый в азотной кислоте разведенной 16 % и аммиака растворе 10 %.
А. К 0,3 мл раствора соли мышьяка(V) (около 30 мг арсенат-иона) прибавляют 0,5 мл хлористоводородной кислоты разведенной 8,3 %, две капли натрия сульфида раствора 2 % и нагревают; образуется желтый осадок, нерастворимый в хлористоводородной кислоте концентрированной, растворимый в аммиака растворе 10 %.
Б. К 0,3 мл раствора соли мышьяка(V) (около 1 мг арсенат-иона) прибавляют 1 – 2 капли серебра нитрата раствора 2 %; образуется коричневый осадок, растворимый в азотной кислоте разведенной 16 % и аммиака растворе 10 %.
В. К 0,3 мл раствора соли мышьяка(V) (около 1 мг арсенат-иона) прибавляют 1 мл аммония хлорида раствора 10 %, 1 мл аммиака раствора 10 % и 1 мл магния сульфата раствора 10 %; образуется белый кристаллический осадок, растворимый в хлористоводородной кислоте разведенной 8,3 % (отличие от арсенитов).
Последние заданные вопросы в категории Химия
Химия 16.10.2023 05:17 20 Ким Маша
При ацирозе крови применяют 4% раствор гидрокарбоната натрия (питьевой соды) Гаити массу воды котору
Ответов: 2
Химия 16.10.2023 05:14 23 Левахин Никита
Среди написанных химических формул выберите те, которые соответствуют веществам, при добавлении воды
Ответов: 2
Химия 16.10.2023 03:52 25 Романова Софья
Массовая доля трехвалентного металла в оксиде равна 78,75 %. Определите формулу оксида.
Ответов: 2
Химия 16.10.2023 03:26 15 Котовский Плюша
16 г цинка прореагировало с 40 л О2. Найти массу оксида цинка если его выход составляет 77%
Ответов: 2
Химия 15.10.2023 23:42 30 Кудрявцев Антон
атом якого елемента має на 4 електрони більше ніж йон натрію.Написати електронну атома цього елемент
Ответов: 2
Химия 15.10.2023 23:10 28 Борисов Илья
Cr(SO4)3+HNO3 дописать уравнение
Ответов: 2
Химия 15.10.2023 22:43 12 Янчук Наталя
В результате разложения каких оснований можно получить оксид? 1-NaOH 4-Zn(OH)27-KOH2-Ca(OH)25-Mg(O
Ответов: 2
Химия 15.10.2023 21:21 18 Смирнов Евгений
Сообщение на тему дельтовая воды по химии 8 класс
Ответов: 2
Химия 15.10.2023 20:50 23 Смирнов Евгений
Химия,спасайте,братцы.
Ответов: 1
Химия 15.10.2023 20:17 7 Трофимчик Паша
Применение этилена в медицине
Ответов: 2
Что такое угольная кислота — структурная формула
При растворении в водной среде углекислый газ образует слабую двухосновную угольную кислоту. Угольная кислота характеризуется наличием ряда органических и неорганических производных: соли, гидрокарбонаты и карбонаты. Соединение является неустойчивым и при обычных условиях не выделяется в свободном состоянии из водных растворов.
С помощью угольной кислоты получают:
- соли (карбонаты и гидрокарбонаты);
- другие более слабые органические и неорганические кислоты (например, кремниевую);
- разнообразные органические производные.
При рассмотрении структурной (графической) формулы угольной кислоты можно сделать вывод о последовательности связей между атомами внутри молекулы:
Молекула угольной кислоты характеризуется плоским строением. Центральный углеродный атом имеет . В гидрокарбонат- и карбонат-анионах можно наблюдать делокализацию -связи. Длина связи С-О в карбонат-ионе равна 130 пм.
Карбонат-ион
Молекула угольной кислоты включает в состав:
- два атома водорода (Ar = 1 а.е.м.);
- один атом углерода (Ar = 12 а.е.м.);
- три атома кислорода (Ar = 16 а.е.м.).
Исходя из химической формулы, определяют молекулярную массу угольной кислоты:
Угольную кислоту формально допустимо рассматривать в виде карбоновой кислоты. При этом гидроксильная группа заменяет углеводородный остаток. В данной форме вещество способно образовывать все производные, которые характерны для карбоновых кислот. Некоторые из подобных соединений:
Угольная кислота, являясь слабым электролитом, обладает способностью в небольшой степени диссоциировать на ионы в водном растворе по уравнению:
Ионная формула угольной кислоты:
Электронная формула угольной кислоты:
Название реакции
Реакция между соляной кислотой (HCl) и бикарбонатом натрия (NaHCO3) широко известна как кислотно-основная реакция или реакция нейтрализации. Эта химическая реакция представлен следующее уравнение:
HCl + NaHCO3 → NaCl + CO2 + H2O
В этой реакции соляная кислота реагирует с бикарбонатом натрия с образованием хлорида натрия (соли), углекислого газа и воды. Давайте пристальный взгляд at детали этой реакции и ее значение.
Понимание реакции
Когда соляная кислота, сильная кислота, вступает в контакт с бикарбонатом натрия, слабым основанием, происходит химическая реакция. Реакция классифицируется как кислотно-основная, поскольку в ней участвуют перевод протона (H+) от кислоты к основанию.
Соляная кислота является сильной кислотой, то есть она полностью диссоциирует в воде с выделением ионов водорода (H+). Бикарбонат натрия, на с другой стороны, является слабым основанием, которое частично диссоциирует в воде с высвобождением ионы бикарбоната (HCO3-) и гидроксид-ионы (ОЙ-).
При смешивании соляной кислоты и бикарбоната натрия ион водородаs реакция кислоты с ионы бикарбоната от базы. В результате этой реакции образуется углекислый газ (CO2), вода (H2O) и хлорид натрия (NaCl), который представляет собой соль.
Значение реакции
Реакция между соляной кислотой и гидрокарбонатом натрия протекает несколько практических применений и имеет научный интерес. Давайте рассмотрим некоторые его значения:
- Пищевая сода и антацид: Бикарбонат натрия, также известный как пищевая сода или бикарбонат соды, обычно используется в выпечке в качестве разрыхлителя. Когда пищевая сода вступает в реакцию с кислотой, например соляной кислотой, образуется углекислый газ, который помогает тесту подняться и дает выпечка легкая текстура.
Кроме того, бикарбонат натрия можно использовать в качестве антацида для облегчения симптомов изжоги или расстройства желудка. При попадании в организм реагирует с избытком желудочная кислота, нейтрализуя его и обеспечивая облегчение.
-
Вскипание и выделение углекислого газа: Известна реакция между соляной кислотой и бикарбонатом натрия. его шипучая природа. Вскипание относится к быстрый побег газа из жидкость, В результате чего формаобразование пузырьков или шипения. В этой реакции выделение углекислого газа приводит к наблюдаемому вскипанию.
-
Уровень pH и сила кислоты: Реакцию между соляной кислотой и бикарбонатом натрия можно использовать для определения pH уровень решения. Измеряя количество кислоты, необходимое для нейтрализации заданная сумма Бикарбоната натрия можно определить кислотность или щелочность раствора. Эта информация имеет решающее значение в различных отраслях промышленности, таких как производство продуктов питания и напитков, фармацевтика и очистка воды.
-
Образование соли: Реакция соляной кислоты с бикарбонат натрия результаты in формахлорид натрия, который широко известен как поваренная соль. Эта соль широко используется в кулинарии, сохранение продуктов питания, и приправы.
В заключение отметим, что реакция между соляной кислотой и бикарбонатом натрия представляет собой кислотно-основную реакцию, в результате которой образуется углекислый газ, вода и хлорид натрия. Эта реакция имеет различные практические приложения, например, в выпечке, антацидах и определение уровня pH. Это также приводит к вскипанию формавведение поваренной соли. Понимание этой реакции может помочь нам оценить ее значение в различных областях.
Часто задаваемые вопросы
2. Почему HCl является водной?
HCl часто используется в его водная форма потому что он легко растворяется в воде, образуя соляную кислоту. Это позволяет более легкая обработка и смешивание с другими веществами.
3. Как изменится энтальпия реакции между NaHCO3 и HCl?
Энтальпия изменение ведь реакция между NaHCO3 и HCl зависит от конкретные условия реакции. Обычно реакция экзотермическая, то есть выделяется тепловая энергия.
4. Почему HCl не проводит электричество?
HCl не проводит электрический ток его чистая форма потому что это ковалентное соединение. Однако при растворении в воде он диссоциирует на ионы (H+ и Cl-), что позволяет ему проводить электричество.
7. Как сбалансировать химическое уравнение NaHCO3 + HCl?
Чтобы сбалансировать химическое уравнение для NaHCO3 + HCl, вам необходимо убедиться, что номер атомов каждый элемент то же самое на обе стороны уравнения. Сбалансированное уравнение: NaHCO3 + HCl → NaCl + H2O + CO2.
9. Какие наблюдения наблюдаются при реакции NaHCO3 с HCl?
Во время реакции между NaHCO3 и HCl можно наблюдать вскипание (пузырение) из-за выделения углекислого газа. Кроме того, раствор может стать теплее.
10. Какое итоговое ионное уравнение реакции между NaHCO3 и HCl?
Итоговое ионное уравнение реакции между NaHCO3 и HCl: H+ + HCO3- → H2O + CO2. Это уравнение представляет общая реакция после устранения зрительские ионы.
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Фосфаты
А. К 1 мл раствора фосфата (10 – 30 мг фосфат-иона), нейтрализованного до рН около 7,0, прибавляют несколько капель серебра нитрата раствора 2 %; образуется желтый осадок, растворимый в азотной кислоте разведенной 16 % и аммиака растворе 10 %.
Б. К 1 мл раствора фосфата (10 – 30 мг фосфат-иона) прибавляют 1 мл аммония хлорида раствора 10 %, 1 мл аммиака раствора 10 % и 0,5 мл магния сульфата раствора 10 %; образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах.
В. К 1 мл раствора фосфата (10 – 30 мг фосфат-иона) в азотной кислоте разведенной 16 % прибавляют 2 мл аммония молибдата раствора 10 % и нагревают; образуется желтый кристаллический осадок, растворимый в аммиака растворе 10 %.
NaHCO 3
Описание бикарбоната натрия (NaHCO3)
Бикарбонат натрия, широко известный как пищевая сода или бикарбонат соды, представляет собой универсальное соединение, находящее различное применение в промышленности. повседневной жизни. Это белый кристалл твердое вещество без запаха и слегка щелочного вкуса. Бикарбонат натрия имеет химическая формула NaHCO3, состоящий из один атом натрия (Na), один атом водорода (H), один атом углерода (C), и три атома кислорода (O).
Упоминание о его кристаллической структуре и природной форме.
Бикарбонат натрия существует в кристаллическая структура, Образуя маленькие белые кристаллы. Эти кристаллы обычно встречаются в порошкообразная форма, что позволяет легко растворять его в воде или другие жидкости. Естественная форма бикарбоната натрия можно найти в минеральные источники, озера и другие природные источники. Его также можно получить синтетически путем химической реакции.
Когда бикарбонат натрия производится естественным путем, его часто называют нахколитом. Наколит — это минерал что происходит в эвапоритовые месторождения и обычно встречается в районах с вулканическая активность. Его добывают и перерабатывают для получения бикарбоната натрия для различных применений.
In его естественная форма, бикарбонат натрия является слабым основанием и может действовать как буфер, помогая поддерживать pH уровень решения. Это свойство делает его полезным в Широкий ассортимент приложений, от приготовления пищи и выпечки до уборки и личной гигиены.
Бикарбонат натрия широко используется в выпечке в качестве разрыхлителя. В сочетании с кислотой, такой как винный камень или уксус, он вступает в кислотно-щелочную реакцию с образованием углекислого газа. Этот газ создает пузыри в тесто или тесто, чтобы оно поднялось и стало легким и пушистым при запекании.
Помимо его кулинарное применениеБикарбонат натрия также используется в качестве антацидного средства для облегчения изжоги и расстройства желудка. При попадании в организм он вступает в реакцию с соляной кислотой в желудке, нейтрализуя ее и снижая кислотность. Эта реакция нейтрализации помогает облегчить дискомфорт вызвано избытком желудочная кислота.
Кроме того, бикарбонат натрия известен его вскипание, то есть выделение углекислого газа при контакте с кислотой. Это шипение часто используется в безрецептурных лекарствах, таких как антациды и обезболивающие, предоставлять шипучее ощущение при употреблении.
В дополнение к его роль в кулинарии и медицине бикарбонат натрия также применяется в различный промышленные процессы. Это ключевой ингредиент в производстве стекла, моющих средств и огнетушители. Он также используется в очистки сточных вод для регулировки pH выровнять и удалить загрязнения.
Подводя итог, бикарбонат натрия (NaHCO3) представляет собой универсальное соединение с кристаллическая структура. Он обычно встречается в его естественная форма как нахколит и может быть получен синтетическим путем. Бикарбонат натрия применяется при выпечке, как антацидное средство и в различные промышленные применения. Его способность вступать в реакцию с кислотами, выделять углекислый газ и действовать как буфер делает его ценным соединением в много разных полей.
Ответы на вопрос
Отвечает Лавренова Екатерина.
Ответ:
Полнаяформа:
Краткаяформа:
Отвечает Назарова Вероника.
В результате реакции между гидрокарбонатом натрия (NaHCO3) и соляной кислотой (HCl) образуются натрия хлорид (NaCl), углекислый газ (CO2) и вода (H2O). Это типичная реакция нейтрализации, где сильная кислота (HCl) реагирует с основанием (NaHCO3) и образует соль (NaCl), основу (CO2) и воду. Образование углекислого газа можно наблюдать как пузырьки или пенообразование в растворе. Эта реакция широко используется в различных областях, включая пищевую промышленность и лабораторные исследования.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
Диоксид углерода + вода угольная кислота
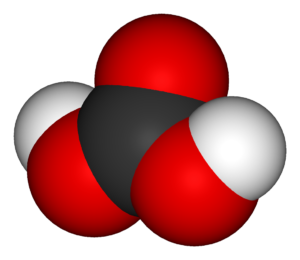 Молекула угольной кислоты
Молекула угольной кислоты
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
Аммиак + углекислота = гидрокарбонат аммония
Углеаммонийная соль
Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
 Оксид цинка
Оксид цинка
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Горение метана.
Горение газа на плите
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Горение этилена
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Горение этана
Этан + кислород = двуокись углерода + вода + энергия
Горение этанола
Молекула этанола
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
В зелёных растениях играет важную роль в процессе фотосинтеза:
Образование глюкозы
Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
Пероксид натрия + углекислота → карбонат натрия + кислород
Колба с пероксидом натрия
Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Способы получения и сфера применения
Угольная кислота всегда присутствует в водных растворах углекислого газа.
В области биохимии высоко ценится способность равновесной системы изменять давление углекислого газа (диоксида углерода) пропорционально изменению содержания ионов гидроксония (кислотности среды) в условиях постоянной температуры. Данное свойство позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
Угольная кислота нашла широкое применение в пищевой промышленности, является важным компонентом в производстве разнообразных шипучих напитков.
Сферы использования солей угольной кислоты:
Получение щелочей
- Щелочи можно получить из гидридов, нитридов, фосфидов, карбидов:
- При растворении оксида щелочного или щелочноземельного металла в воде образуется раствор щелочи:
Na2O + H2O = 2NaOH
BaO + H2O = Ba(OH)2
Реакции идут с выделением большого количества теплоты, то есть являются экзотермическими.
- Щелочи можно получить растворением пероксидов в воде (характерно для получения гидроксида натрия, гидроксида калия и гидроксида бария):
Na2O2 + 2H2O = H2O2 + 2NaOH
BaO2 + 2H2O = H2O2 + Ba(OH)2
- Раствор щелочи получают при растворении щелочного или щелочноземельного металла в воде:
- Растворы щелочей можно получить обменными реакциями:
Li2SO4 + Ba(OH)2 = 2LiOH + BaSO4↓
K2SO4 + Sr(OH)2 = 2KOH + SrSO4↓
- Раствор щелочи можно получить электролизом раствора соли, содержащей катион щелочного или щелочноземельного металла и бескислородный анион, например раствор гидроксида калия получают электролизом раствора хлорида калия:
Анод: 2Cl‒ ‒2ē = Cl2
Как связаны щелочи с основаниями?
Щелочи – это небольшая группа неорганических веществ, относящихся к основным гидроксидам или основаниям. Для начала разберемся, какие вещества можно называть основаниями. Основания – это вещества, содержащие гидроксо-группу (‒OH), которая в неорганической химии (в случае с основаниями) пишется в конце молекулы, например: NaOH, Fe(OH)2, Ba(OH)2, но это определение не точное, ведь Fe(OH)3 и Zn(OH)2 имеют сходную формулу, однако, основаниями не являются. Точнее будет сказать, что основания – это гидроксиды, в которых металл находится в степени окисления «+1» или «+2» (кроме цинка и бериллия, образующих в степени окисления «+2» амфотерные оксиды и гидроксиды).
Таблица 1. – Основания и амфотерные гидроксиды
|
Это основания: |
Это НЕ основания: |
|
NaOH KOH Mg(OH)2 Ca(OH)2 Fe(OH)2 |
Al(OH)3 Fe(OH)3 Cr(OH)3 Zn(OH)2 Be(OH)2 |
|
Потому что содержат металл в степени окисления «+1» или «+2» |
Так как в этой группе есть гидроксиды, имеющие металл в степени окисления «+3», и два исключения — Zn(OH)2 и Be(OH)2. Все приведенные выше вещества являются амфотерными гидроксидами, а не основаниями |
Подробнее об отличиях понятий «гидроксиды» и «основания» можно прочитать в статье «Классификация гидроксидов и оснований»
Кроме отличий в степени окисления, основания и амфотерные гидроксиды отличаются так же по реакционной способности. Так, амфотерные гидроксиды могут реагировать как с кислотами, так и с основаниями, а основания могут реагировать с кислотами, но не могут реагировать с другими основаниями. Подробнее о химических свойствах амфотерных гидроксидов можно прочитать в статье «Амфотерные гидроксиды. Получение, химические свойства, образование средних и комплексных солей»
Топ вопросов за вчера в категории Химия
Химия 20.06.2023 14:08 2124 Сапалов Андрей
№1. Определить валентность элементов в веществах. SiH4. CrO3. H2S. CO2. CO. SO3. SO2. Fe2O3. FeO.
Ответов: 1
Химия 01.07.2023 02:03 765 Шкребец Макс
Составьте формулу соединений железа (III) с серой
Ответов: 2
Химия 18.05.2023 16:56 867 Амангелды Моля
Определить валентность: FeS, Al2S3, SCl2, SCl4, CO, CO2, Na3P, Ca3P2
Ответов: 2
Химия 04.07.2023 04:40 698 Кривич Алексей
Вопрос Верны ли следующие суждения об условиях протекания реакций ионного обмена? А. Если в раство
Ответов: 2
Химия 23.09.2023 10:29 579 Бороденко Сергей
Задание 1 (60 баллов). Заполните таблицу для следующих явлений: сгибание медной проволоки; таяние
Ответов: 1
Химия 22.02.2021 12:23 324 Федів Антон
Рассчитайте массовые доли элементов в оксиде углерода (IV) – углекислом газе При выполнении задани
Ответов: 2
Химия 18.05.2023 12:20 237 Мерзлякова Света
Тест «Вода» 1.Какое свойство воды указано неверно: 1) прозрачна 3) бесцветна 2) не имеет запаха 4)
Ответов: 3
Химия 28.09.2023 06:32 106 Леонтьев Никита
Из предложенного перечня выберите две пары веществ, которые при комнатной температуре реагируют друг
Ответов: 2
Химия 03.10.2023 07:21 338 Романова Анна
Будут ли верны следующие утверждения при решении задачи расчёта соотношения масс железа и хлора в мо
Ответов: 2
Химия 01.07.2023 19:18 487 Романова Катя
Вопрос Массовая доля углерода одинакова в двух веществах, формулы которыхC2H4CH4C6H6C2H6C5H10
Ответов: 2
Как определить, является ли основание растворимым, то есть щелочью, если его нет в таблице растворимости?
В состав щелочей входят металлы IА-группы Периодической Системы Д. И. Менделеева, а также кальций, стронций и барий.
Полный список щелочей:
NaOH – гидроксид натрия, едкий натр, гидроокись натрия, каустическая сода
KOH – гидроксид натрия, едкое кали, гидроокись калия
LiOH – гидроксид лития, гидроокись лития
CsOH – гидроксид цезия, гидроокись цезия
FrOH – гидроксид франция, гидроокись франция
RbOH – гидроксид рубидия, гидроокись рубидия
Ba(OH)2 – гидроксид бария, едкий барий, баритовая вода
Ca(OH)2 – гидроксид кальция, гашеная известь, известковое молоко, известковая вода.
Sr(OH)2 – гидроксид стронция
Остальные основания считаем нерастворимыми (кроме аммиака, образующего гидрат аммония, являющегося хоть и растворимым, но нестойким соединением). Гидроксид аммония, образующийся при пропускании аммиака через воду, можно представить в виде формулы NH4OH (лучше NH3·H2O – гидрат аммония) является растворимым (раствор называют нашатырным спиртом), однако щелочью это вещество не является.
Гидроксид лития и гидроксид кальция растворяются не так хорошо, как другие основания, но все равно считаются щелочами.
Задание в формате ЕГЭ с ответом:
- Ga(OH)3
- RbOH
- Cr(OH)2
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Ответ:
| А | Б | В |
|---|---|---|
Ответить
Комментарий к заданию: Галлий, в представленном гидроксиде, имеет степень окисления +3, поэтому он относится к группе амфотерных гидроксидов. Гидроксид рубидия – щелочь, так как рубидий – элемент IА-группы. Гидроксид хрома – нерастворимое основание, так как хром в степени окисления +2 не является амфотерным, и не относится к щелочным или щелочноземельным металлам, поэтому не может образовать щелочь.
Пример задания из КИМ ЕГЭ:
- Sr(OH)2
- Zn(OH)2
- Fe(OH)2
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Ответ:
| А | Б | В |
|---|---|---|
Ответить
Комментарий к заданию: Стронций является щелочноземельным металлом (металлы IIА-группы, кроме магния и бериллия, образуют растворимые гидроксиды), поэтому образует щелочь. Гидроксид цинка вместе с гидроксидом бериллия входят в группу исключений и, несмотря на вторую валентность, образуют амфотерные гидроксиды. Гидроксид железа нерастворим и не входит в группу амфотерных веществ, он является нерастворимым основанием.
Щёлочи, являясь сильными основаниями, диссоциируют в воде очень быстро, тогда как нерастворимые основания диссоциируют медленно, ступенчато:
|
Диссоциация щелочей |
Диссоциация слабых оснований |
|
Ca(OH)2 = Ca2+ + 2OH‒ |
Fe(OH)2 = FeOH+ + OH‒ (I ступень) FeOH+ = Fe2+ + OH‒(II ступень) |
|
Диссоциация настолько быстрая, что ступенчатостью процесса можно пренебречь |
Диссоциация очень медленная, быстрее идет по первой ступени, по второй ступени практически не идёт |































