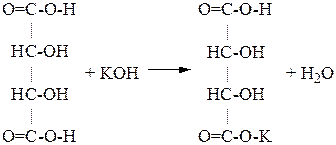Похожие:
| Пищевые добавкиФормы работы: интерактивная лекция, лабораторная работа, индивидуальная, групповая | Лабораторная работа №1Химия: I курс: рабочая тетрадь для лабораторных и практических работ/ Л. Ф. Шатило | ||
| Разработка урока химии в 10 классе «Углеводы. Классификация. Глюкоза. Строение. Изомерия»Технологии, использованные на уроке: икт, технология развития критического мышления через чтение и письмо (работа с текстом в стратегиях… | А13. Чистые вещества и смеси. Правила безопасной работы в школьной…Лабораторная посуда и оборудование. Человек в мире веществ, материалов и химических реакций. Проблемы безопасного использования веществ… | ||
| Вода + углекислый газ + свет → углеводы + кислородЭтот процесс преобразования солнечной энергии в энергию химических связей называется фотосинтезом. Другие живые организмы получают… | Контрольная работа Русский языкКонтрольная работа на основе художественного текста (чтение и работа с информацией) | ||
| Календарно-тематическое планирование по географии 10 классПрактическая работа №1 «Работа по измерительным ресурсам географических и топографических карт» | Методическая разработка урока по теме: «Аллотропные видоизменения углерода»Формы работы: работа в группах, работа с учебником и дополнительной литературой, применение интернет-ресурсов | ||
| Курсовая работаКурсовая работа самостоятельная разработка конкретной темы с элементами научного анализа, отражающая приобретенные студентом теоретические… | Пояснительная записка Контрольная работа разработана для выявления…Контрольная работа включает в себя задания составленные по следующим темам изученным в 1 семестре текущего года |
Химические свойства фенола
Наличие в молекуле фенола как гидроксильной группы, так и бензольного кольца в углеводородном радикале фениле обусловливает его химические свойства.
Проблема. Опираясь на знание строения фенола и взаимного влияния атомов и групп атомов в его молекуле, предскажите возможные реакции, в которые он вступает.
Наличие группы —ОН в молекуле делает некоторые его свойства схожими со свойствами спиртов.
1. Фенол реагирует с щелочными металлами.
Демонстрационный опыт. В расплавленный фенол опустим небольшой кусочек очищенного и осушенного натрия. Происходит химическая реакция с выделением водорода (поджигаем лучинкой) и образованием фенолята натрия (подобного алкоголятам):
2. В отличие от одноатомных спиртов фенол реагирует со щелочами.
Демонстрационные опыты по исследованию химических свойств фенола
Оборудование и реактивы: аппарат Киппа (заряженный на углекислый газ), фенол кристаллический, 3%-й раствор фенола, бромная вода (6 капель брома на 50 мл воды), 10%-й раствор NaOH, 1 %-й раствор FeCl3 5%-й раствор НСl, растворы лакмуса и фенолфталеина, 5 пробирок, спиртовка, микрошпатель.
Реакции с участием гидроксильной группы
1) В пробирку с помощью пипетки внесем 5 капель 10%-го раствора гидроксида натрия и 1 каплю фенолфталеина, раствор слабо окрасится в малиновый цвет. К раствору щелочи добавим по каплям (до исчезновения окраски) раствор фенола в воде. После добавления каждой капли фенола пробирку с содержимым нужно взбалтывать. Наблюдаем изменения внешнего вида раствора. Напишите уравнение реакции.
2) Полученный раствор фенолята натрия разделим на две части, отлив половину его в другую пробирку. В первую пробирку с фенолятом натрия добавим немного разбавленной соляной кислоты. Что вы наблюдаете? Через содержимое второй пробирки пропустим из аппарата Киппа углекислый газ. Что вы наблюдаете? Запишите уравнения произошедших реакций.
Реакции с участием бензольного кольца
1) В пробирку внесем 1 каплю раствора фенола и добавим по каплям бромную воду до появления белой взвеси, которая затем выпадает в осадок. Составьте уравнение реакции. Эта реакция служит для обнаружения (идентификации) фенола.
2) В пробирку внесем каплю раствора фенола и 5 капель воды. Добавим к содержимому пробирки 1-2 капли раствора хлорида железа (III). Наблюдаем изменение цвета раствора. Каков он? (Уравнение этой реакции писать не надо, в результате ее образуется сложное комплексное соединение.) Данная реакция фенола с раствором FeCl3 является качественной реакцией на фенол.
Техника безопасности при проведении опытов с фенолом
При проведении всех опытов с фенолом будьте осторожны! Работы с фенолом возможны только в защитных очках или маске! Попадание фенола на кожу вызывает ожог!
После выполнения опытов содержимое всех пробирок в раковину не выливается, а сливается в специально приготовленную посуду. Пробирки нужно хорошо промыть водой. После окончания работы необходимо тщательно вымыть руки.
Экспериментально установили, что фенол — химически активное вещество. Как и спирты, он реагирует со щелочными металлами, например с натрием, в результате чего образуются водород и фенолят натрия (солеобразное соединение). Это реакция замещения: на металл замещается водород гидроксильной группы.
Но в отличие от одноатомных спиртов фенол взаимодействует и со щелочами, в частности, вы наблюдали реакцию с гидроксидом натрия.
Проблема. Чем объяснить эту характерную для кислот реакцию фенола со щелочами?
Экспериментально вы исследовали свойства фенолята натрия. Вы наблюдали, что он взаимодействует с соляной кислотой, образуя фенол и воду, а при реакции фенолята натрия с угольной кислотой (она образовалась при пропускании углекислого газа через водный раствор фенолята натрия) раствор мутнеет. Это свидетельствует об образовании фенола, плохо растворимого в холодной воде. Это также доказывает, что даже такая слабая кислота, как угольная, способна вытеснять фенол из фенолята, т. е. что фенол обладает еще более слабыми кислотными свойствами, чем угольная кислота.
3. Вы также наблюдали реакцию фенола с бромной водой. Признаком ее было образование белого осадка трибромфенола, его формула — Вr3С6Н2—ОН, которая доказана экспериментально. Три атома водорода в бензольном кольце замещаются на атомы брома.
Бензол с бромной водой не реагирует, а с бромом взаимодействует лишь при наличии катализатора (железные опилки), причем бром замещает в бензольном ядре только один атом водорода.
Проблема. Почему реакция фенола с бромом протекает с большей легкостью, чем с бензолом, и при этом замещаются в бензольном ядре три атома водорода, а не один, как в случае с бензолом? Постарайтесь решить эту проблему самостоятельно!
Молочная кислота
| Молочная кислота | ||
|---|---|---|
|
||
| Систематическое
наименование |
2-гидроксипропановая кислота | |
| Хим. формула | CH3CH(OH)COOH | |
| Рац. формула | C3H6O3 | |
| Молярная масса | 90,08 г/моль | |
| Плотность | 1,225 г/см³ | |
| Температура | ||
| • плавления | 18 °C | |
| • кипения | 122 °C | |
| Константа диссоциации кислоты pKa | 3,86 (при 25 °C) | |
| ГОСТ | ГОСТ 490-2006 ГОСТ 490-79 | |
| Рег. номер CAS | 50-21-5 | |
| PubChem | 612 | |
| Рег. номер EINECS | 200-018-0 | |
| SMILES |
CC(O)C(=O)O |
|
| InChI |
1S/C3H6O3/c1-2(4)3(5)6/h2,4H,1H3,(H,5,6) JVTAAEKCZFNVCJ-UHFFFAOYSA-N |
|
| Кодекс Алиментариус | E270 | |
| ChEBI | 78320 | |
| ChemSpider | 592 | |
| Сигнальное слово | Опасно | |
| Пиктограммы СГС | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
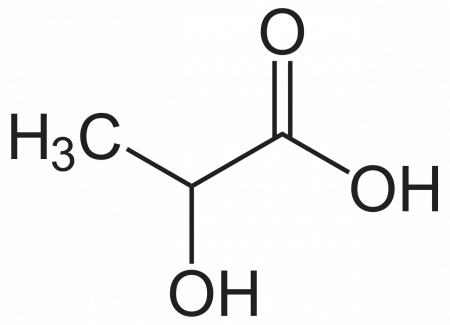
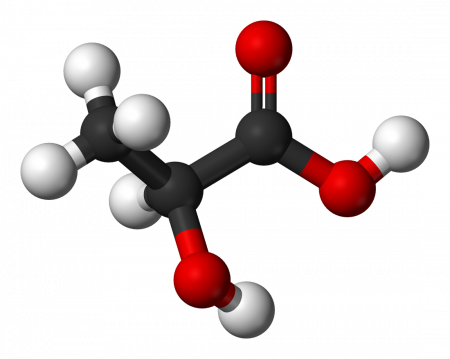
Молочная кислота (α-оксипропионовая, 2-гидроксипропановая кислота) CH3CH(OH)COOH — одноосновная карбоновая кислота с тремя атомами углерода, содержащая гидроксильную группу. Соли и эфиры молочной кислоты называются лактатами. Молочная кислота образуется при молочнокислом брожении сахаров и играет важную роль в метаболизме.

Получение
Ферментативное получение
В промышленности молочную кислоту получают либо ферментативным способом, либо синтетическим. Первый из них имеет преимущество, поскольку приводит к молочной кислоте с более высокой стереохимической чистотой, поэтому новые производства, открывавшиеся с 1995 года, пользуются этим способом.
Для ферментативного производства молочной кислоты необходимо иметь углеводное сырьё, питательные вещества и соответствующие микроорганизмы. В качестве сырья используют глюкозу, кукурузные сиропы, мелассу, сок сахарной свёклы, сыворотку и крахмал. Питательными веществами являются пептиды и аминокислоты, фосфаты, соли аммония и витамины. Здесь находят применение дрожжевой экстракт, кукурузный ликёр, кукурузная глютеновая мука, солодовые ростки, соевый или мясной пептон. Молочную кислоту из углеводов вырабатывают культуры Lactobacillus, Bacillus и Rhizopus. Последняя из них является грибной и не требует сложных источников азота, хотя и даёт более низкий выход, чем бактериальные культуры.
Во время процесса вырабатывается кислота, поэтому необходимо поддерживать pH в области 5,0-6,5: для этого используют гидроксид кальция, карбонат кальция, аммиак и гидроксид натрия. Из-за этого в процессе ферментации образуются соответствующие соли молочной кислоты. Разработка новых подходов к ферментации связана с выведением бактерий, способных работать в области низких pH: это позволило бы получать саму молочную кислоту, а не её соли, снизило бы затраты на подщелачивающие реагенты и на серную кислоту, используемую для выделения молочной кислоты из солей.
После ферментации молочную кислоту подвергают очистке. Микроорганизмы отделяют флокуляцией в щелочной среде либо ультрафильтрацией. Образовавшиеся соли молочной кислоты переводят в саму кислоту под действием серной кислоты. При этом образуется также малополезный сульфат кальция. Ведётся поиск других методов очистки, при которых образование это побочной соли не происходило бы. Для некоторых пищевых целей смесь пропускают через активированный уголь и ионообменную колонну.
Для фармацевтической промышленности и получения полимеров необходима более глубокая очистка. Интерес представляет экстракция молочной кислоты в органическую фазу длинноцепными третичными аминами, а затем обратная экстракция в воду. Этот метод позволяет эффективно очистить продукт от остаточных углеводов и белков. Также возможна перегонка молочной кислоты, если предпринимаются меры против её олигомеризации.
Выход молочной кислоты в процессе ферментации составляет 85-95 %. Побочными продуктами являются муравьиная и уксусная кислота.

Синтетическое получение
С 1960-х гг. рацемическую молочную кислоту производят в промышленности также синтетически. Подход основан на реакции ацетальдегида с циановодородом и последующем гидролизе образовавшегося лактонитрила. Недостатком синтетического подхода является то, что получаемая молочная кислота является рацемической, а подходящий и дешёвый хиральный катализатор пока не найден. Последним крупным производителем синтетической молочной кислоты является фирма «Musashino».
Экономические аспекты
Годовая потребность в молочной кислоте составляет примерно 450 тыс. тонн. Крупнейшим производителем молочной кислоты является компания NatureWorks LLC: её завод, размещённый в штате Небраска (США), имеет приблизительную мощность 180 тыс. тонн в год. Это в 3-4 раза больше, чем у следующего завода по порядку. Рынок молочной кислоты очень чувствителен к потребности в полилактиде, поскольку его производство является либо вскоре станет крупнейшим направлением использования молочной кислоты.
Химические свойства фенола
Наличие в молекуле фенола как гидроксильной группы, так и бензольного кольца в углеводородном радикале фениле обусловливает его химические свойства.
Проблема. Опираясь на знание строения молекулы фенола и взаимного влияния атомов и групп атомов в его молекуле, предскажите возможные реакции, в которые он вступает.
Наличие группы —ОН в молекуле делает некоторые его свойства схожими со свойствами спиртов.
1. Фенол реагирует с щелочными металлами.
Демонстрационный опыт. В пробирку с расплавленным фенолом поместим небольшой кусочек очищенного и осушенного натрия. Происходит химическая реакция с выделением водорода (поджигаем лунинкой) и образованием фенолята натрия (подобного алко- голятам):
2. Фенол обладает слабыми, но более сильными, чем у одноатомных спиртов, кислотными свойствами. Вследствие этого и в отличие от одноатомных спиртов фенол реагирует, как и многоатомные спирты, со щелочами.
Задание. Напишите уравнение реакции фенола с гидроксидом натрия, укажите её тип и условия протекания.
Демонстрационные опыты по исследованию химических свойств фенола.
Оборудование и реактивы: фенол кристаллический, 3%-й раствор фенола, бромная вода (6 капель брома на 50 мл воды), 10%-й раствор NaOH, 1 %-й раствор FeCl3, растворы лакмуса и фенолфталеина, 5 пробирок, спиртовка, микрошпатель.
Техника безопасности
При проведении всех опытов с фенолом будьте осторожны! Работы с фенолом возможны только в защитных очках или маске! Попадание фенола на кожу вызывает ожог!
После выполнения опытов содержимое всех пробирок не выливается в раковину, а сливается в специально приготовленную посуду. Пробирки хорошо промываются водой. После окончания работы необходимо тщательно вымыть руки.
Реакции с участием гидроксильной группы
1. В пробирку с помощью пипетки внесём 5 капель 10%-го раствора гидроксида натрия и 1 каплю фенолфталеина, раствор слабо окрасится в малиновый цвет. К раствору щёлочи добавим по каплям (до исчезновения окраски) водный раствор фенола. После добавления каждой капли раствора фенола пробирку с содержимым взбалтываем. Наблюдаем изменения внешнего вида раствора. Образуется фенолят натрия. 2. Полученный раствор фенолята натрия разделим на две части, отлив половину его в другую пробирку. В первую пробирку с фенолятом натрия добавим немного разбавленной соляной кислоты. Что вы наблюдаете? Через содержимое второй пробирки пропустим из аппарата Киппа углекислый газ. Что вы наблюдаете? Запишите уравнения произошедших реакций.
Реакции с участием бензольного кольца
1.В пробирку внесём 1 каплю раствора фенола и добавим по каплям бромную воду до появления белой взвеси, которая затем выпадает в осадок. Составьте уравнение реакции. Эта реакция служит для обнаружения (идентификации) фенола.
2. В пробирку внесём каплю раствора фенола и 5 капель воды. Добавим к содержимому пробирки 1-2 капли раствора хлорида железа (III). Наблюдаем изменение цвета раствора. Каков он? (Уравнение этой реакции писать не надо, в результате её образуется сложное комплексное соединение.) Данная реакция фенола с раствором FeCl3 является качественной реакцией на фенол.
Экспериментально установили, что фенол — химически активное вещество.
Указания к лабораторной работе №11
СЕМИПАЛАТИНСКАЯ государственная медицинская академия
Методические рекомендации к проведению лабораторного занятия
Специальность:0501301 Общая медицина
Дисциплина:химия
Кафедра: химии и технологии лекарств
Высшее базовое медицинское образование, курс – 1
Тема №10: Альдегиды и кетоны. Карбоновые и дикарбоновые кислоты.
Составители: доцент Гавриленко И.В.
ст. преп. Майжанова Т.К.
преп. Павлова Н.И.
на заседании кафедры химии и технологии лекарств
От «_____ » ________ 2007 г.
Заведующая кафедрой химии
и технологии лекарств, доцент ___________ И.В. Гавриленко
Тема №11: Гетерофункциональные органические соединения. Таутомерия. Стереоизомерия.
2. Цель:Изучить строение отдельных представителей гетерофункциональных соединений: гидрокси-, оксо-, фенолокислот и их специфические свойства, кето-енольную таутомерию и стереоизомерию
3. Задачи обучения. Научить писать проекционные формулы Фишера и уравнения реакций характеризующие химические свойства оксо- и гидроксикислот, практически выполнять некоторые качественные реакции. Изучение темы способствует формированию знаний о специфических свойствах алифатических гетерофункциональных соединений, как основы для понимания их метаболических превращений в организме.
1. Гетерофункциональные соединения, их классификация и реакционная способность.
2. Гидрокислоты (молочная, b-, g-гидроксимасляная, g-гидроксивалериановая). Структура и свойства. Биологическая роль гидроксикислот.
3. Многоосновные гидроксикислоты: яблочная, лимонная – метаболиты нашего организма.
4. Оксокислоты (пировиноградная, ацетоуксусная, a-кетоглутаровая, щавелевоуксусная ).
5. Салициловая кислота
6. Кето-енольная таутомерия.
Методы обучения и преподавания:
Определение входного уровня знаний, беседа по теме занятия, работа в парах — выполнение лабораторной работы и оформление отчета. Итоговый контроль знаний.
Указания к лабораторной работе №11
Тема: Гетерофункциональные органические соединения. Таутомерия. Стереоизомерия.
Опыт №1. Реакция Уффельмана на молочную кислоту.
В пробирку вносят 10-12 капель реактива Уффельмана (по 5-6 капель раствора фенола и хлорного железа), имеющего фиолетовую окраску, добавляют 1-2 капли молочной кислоты и взбалтывают. Появляется зеленовато-желтое окрашивание, обусловленное образованием молочно-кислого железа.
Опыт №2. Доказательство наличия двух гидроксигрупп в виннокаменной кислоте.
В пробирку помещают 5-6 капель 10%-ного раствора гидроксида натрия, 1-2 капли 5% раствора сернокислой меди СuSО4 и 8-10 капель сегнетовой соли (двойная соль калия натрия виннокаменной кислоты). Происходит растворение гидрата окиси меди с образованием алкоголята меди синего цвета. Химизм реакции:
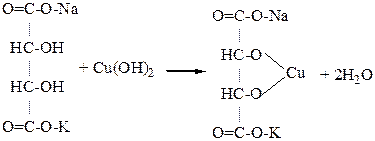
Опыт №3. Получение средней и кислой солей виннокаменной кислоты.
В пробирку наливают 5-6 капель 1% раствора виннокаменной кислоты и прибавляют 1-2 капли 5% раствора едкого калия. Содержимое пробирки перемешивают стеклянной палочкой (создание центров кристаллизации) до появления осадка кислой соли виннокаменной кислоты (1). После этого в пробирку добавляют несколько капель 5% раствора NaOH до растворения осадка. Образуется хорошо растворимая в воде двойная соль калия натрия виннокаменной кислоты (2), называемая сегнетовой солью.
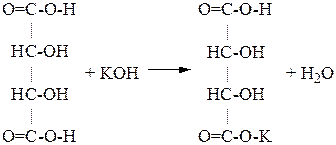
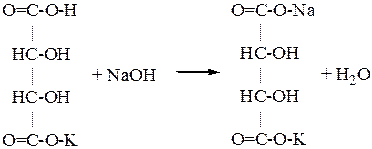
Сделайте вывод из наблюдаемых явлений
6. Литература:
1. Н.А. Тюкавкина, Ю.П. Бауков. Биоорганическая химия. М., 1991. с.68-82, 230-238, с. 246, с. 256-267
2. Н.А. Тюкавкина. Руководство к лабораторным занятиям по биоорганической химии. 1985., с. 138-142, 154-156
3. П.А. Верболович. Практикум по органической, физической и коллоидной химии. 1973., раб. 78 (1), 79, 80.
7. Контроль:
1. Напишите уравнение реакции переаминирования (трансаминирования) между 2-аминопропановой и a-кетоглутаровой кислотами
2. Укажите аналитический эффект качественной реакции на молочную кислоту.
3. Напишите специфические реакции, протекающие при нагревании a-, b-, g- гидроксикислот
4. Напишите проекционные формулы энантиомеров молочной и яблочной кислот. Как определяется их принадлежность к D или L-стереохимическим рядам?
Тема 1.16. Исследование преобразований аминокислот (дезаминирование, трансаминирование, декарбоксилирование)
В живом организме все обменные процессы идут при участии ферментов, которые являются биологическими катализаторами. Активность ферментов зависит от ряда факторов и является определенным показателем состояния организма.
Для аминокислот характерны реакции трех типов: реакции дезаминирования, реакции трансаминирования и реакции декарбоксилирования.
Большое значение в клинической практике имеет определение активности аминотрансфераз и, в частности, аспарагиновой (АсАТ) и аланиновой (АлАТ) аминотрансфераз. Эти ферменты являются органоспецифическими. Так, АсАТ преобладает в сердечной мышще, а АлАТ – в печени. При нарушении целостности клеточных мембран органоспецифические ферменты в больших количествах попадают в кровь, что проявляется в их повышенной активности в крови. Поэтому при инфаркте миокарда используется, среди прочих методов диагностики, определение активности АсАТ, а при остром гепатите – преимущественно АлАТ. При хронических поражениях печени повышена активность обоих ферментов.
Теперь ознакомьтесь с целями занятия.
Уметь интерпретировать общие пути обмена аминокислот и результаты определения активности аминотрансфераз в сывортке крови с целью дальнейшего использования на клинических кафедрах для диагностики патологии внутренних органов.
Конкретные цели: Цели исходного уровня
1. Интерпретировать биологическую роль реакций дезаминирования, трансами-нирования и декарбоксилирования в обмене аминокислот
2. Интерпретировать изменения актив-ности АсАТ
Интерпретировать качественные реакции на a-кетокислоты с 2,4 ДНФГ (кафедра медицинской и фармацевтической химии)
3. Интерпретировать изменения актив-ности АлАТ
Интерпретировать определение концент-рации вещества в растворе по его оптиче-ской плотности (кафедра медицинской и фармацевтической химии)
4.Интерпретировать биологическую роль реакций окислительного дезаминирования и альфа-декарбоксилирования в обмене аминокислот
Для проверки исходного уровня предлагается выполнить ряд заданий.
Задания для самопроверки и самокоррекции исходного уровня.
Задание 1. В биохимической лаборатории лаборант строила калибровочную кривую зависимости концентрации вещества от оптической плотности. Были получены приводимые ниже результаты.
Концентрация 15 мг/л — экстинкция 0,015;
Концентрация 25 мг/л – экстинкция 0,025;
Концентрация 50 мг/л – экстинкция 0,05;
Концентрация 75 мг/л – экстинкция 0,075;
Концентрация 100 мг/л-экстинкция 0,1 (оптических единиц).
Каквыглядит данная калибровочная кривая?
С. Прямая, отражающая обратнопропорциональную зависимость
Е. Прямая, отражающая прямопропорциональную зависимость
Задание 2. Во время практической работы студент на ФЭКе определял экстинкцию раствора сульфата меди в пяти пробирках с различными концетрациями данного вещества. В какой пробирке концентрация сульфата меди была самая низкая, если экстинкция растворов составила:
Задание 3. Для определения активности АлАТ студент использовал 2,4-ДНФГ. По количеству какой образовавшейся кислоты можно судить об активности фермента?
Задание 4. Для определения активности АсАТ студент использовал 2,4-ДНФГ. По количеству какой образовавшейся кислоты можно судить об активности фермента?
Правильность решений проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к решению заданий для самопроверки и самоконтроля исходного уровня:
Информацию для восполнения исходного уровня можно найти в следующей литературе:
1.Тюкавкина Н.А.,Бауков Ю.И. Биоорганическая химия. -М.: Медицина, 1991. – С.252-256
2.Рево А.Я.,Зеленкова В.В. Руководство к лабораторным занятиям по биоорганической химии.- М.: Медицина, 1980. –С.27-29
3.Лекции по биоорганической химии
Содержание обучения должно обеспечивать достижение целей обучения, чему способствует граф логической структуры изучаемой темы (Приложение 1).
источник
Практическая работа по химии анализ лекарственных препаратов
Гипермаркет знаний>>Химия>>Химия 10 класс>> Химия: Практическая работа № 11. Анализ лекарственных препарато
Анализ лекарственных препаратов, производных салициловой кислоты
1. Салициловая кислота (о-гидроксибензойная кислота).
2. Аспирин, ацетилсалициловая кислота (салициловый эфир уксусной кислоты).
3. Салол (фениловый эфир салициловой кислоты).
Напишите структурные формулы указанных соединений. Укажите, в чем состоит различие в строении этих соединений, какие функциональные группы входят в состав каждого из соединений (карбоксильная, фенольный гидроксил, сложноэфирная группа). Опишите лекарственное действие этих соединений.
1. Разотрите в ступке таблетки каждого из этих лекарств. Перенесите в пробирки по 0,1 г каждого лекарства (приблизительно одна пятая часть таблетки). Для сравнения свойств можно взять аспирин различного производства, например английский, немецкий, российский. Добавьте в каждую пробирку 2—3 мл воды и отметьте растворимость лекарств в воде. Нагрейте на спиртовке пробирки с веществами до кипения. Что наблюдается?
2. Внесите в пробирки приблизительно по 0,1 г лекарственных препаратов и добавьте по 2—3 мл этанола. Что наблюдается? Нагрейте на спиртовке пробирки до полного растворения осадков. Сравните растворимость лекарственных препаратов в воде и этаноле.
3. Взболтайте по 0,1 г препарата с 2—3 мл воды и добавьте по 2—3 мл разбавленного раствора щелочи (КаОН). Изменилась ли растворимость веществ? Объясните наблюдаемые явления, напишите уравнения соответствующих реакций.
4. Взболтайте по 0,1 г каждого препарата с 2—3 мл воды и добавьте несколько капель раствора хлорида железа(Ш). Что наблюдается? В каких пробирках произошло изменение окраски? Объясните наблюдаемое явление.
Анализ лекарственных препаратов, производных n-аминофенола
1. Парацетамол (n-N-ацетиламинофенол).
2. Фенацетин (1-зтокси-4-ацетаминобензол).
Напишите структурные формулы указанных соединений. Укажите, в чем состоит различие в строении этих соединений, какие функциональные группы входят в состав каждого из соединений (фенольный гидроксил, амид, простой эфир). Опишите лекарственное действие этих соединений.
Эксперимент1. Разотрите в ступке таблетки каждого из этих лекарств. Перенесите в пробирки по 0,1 г каждого лекарства (приблизительно одна пятая часть таблетки). Для сравнения свойств можно взять аспирин различного производства, например английский, немецкий, российский. Добавьте в каждую пробирку 2—3 мл воды и отметьте растворимость лекарств в воде. Нагрейте на спиртовке пробирки с веществами до кипения. Меняется ли растворимость лекарств в воде в зависимости от температуры?
2. Внесите в пробирки по 0,1 г лекарственного препарата и добавьте в каждую по 2—3 мл этанола. Отметьте растворимость веществ в зтаноле. Нагрейте пробирки до кипения. Что наблюдаете?
3. Взболтайте по 0,1 г каждого препарата с 2—3 мл воды и добавьте несколько капель хлорида железа(III). Что наблюдается? В какой пробирке произошло изменение окраски? Объясните наблюдаемое явление.
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь — Образовательный форум.
Источник
Молочная кислота в организме человека и животных
Молочная кислота формируется при распаде глюкозы. Иногда называемая «кровяным сахаром» глюкоза является главным источником углеводов в нашем организме. Это основной источник энергии для мозга и нервной системы, так же как и для мышц во время физической нагрузки. Когда расщепляется глюкоза, клетки производят АТФ (аденозинтрифосфат), который обеспечивает энергией большинство химических реакций в организме. Уровень АТФ определяет, как быстро и как долго мышцы смогут сокращаться при физической нагрузке.
Производство молочной кислоты не требует присутствия кислорода, поэтому этот процесс её синтеза часто называют «анаэробным метаболизмом» (см. Анаэробная тренировка). Ранее считалось, что мышцы производят молочную кислоту при нехватке кислорода в крови. Другими словами, организм находится в анаэробном состоянии. Однако современные исследования показывают, что молочная кислота образуется и в мышцах, получающих достаточно кислорода. Увеличение количества молочной кислоты в кровотоке свидетельствует лишь о том, что уровень её поступления превышает уровень удаления. Резкое увеличение (в 2-3 раза) уровня лактата в сыворотке крови наблюдается при тяжёлых расстройствах кровообращения, таких как геморрагический шок, острая левожелудочковая недостаточность и др., когда одновременно страдает и поступление кислорода в ткани, и печёночный кровоток.
Зависимое от лактата производство АТФ очень незначительно, но имеет большую скорость. Это обстоятельство делает идеальным его использование в качестве источника энергии, когда нагрузка превышает 50 % от максимальной. При отдыхе и умеренной нагрузке организм предпочитает расщеплять жиры для получения энергии. При нагрузках в 50 % от максимума (порог интенсивности для большинства тренировочных программ) организм перестраивается на преимущественное потребление углеводов. Чем больше углеводов человек использует в качестве топлива, тем больше производство молочной кислоты.
Исследования показали, что у престарелых людей в головном мозге количество солей кислоты (лактатов) имеет повышенный уровень.
Безопасность
Молочная кислота — это органическая карбоновая кислота, которая присутствует во многих организмах и является безопасной для окружающей среды. Увеличение производства молочной кислоты и, соответственно, полилактида оказывает положительное влияние тем, что вытесняет использование полимеров, производимых из нефти, снижает выбросы углекислого газа и предоставляет более широкие возможности по утилизации отходов.
Молочная кислота также используется в пищевой промышленности и не является токсичной. Тем не менее при попадании в глаза или на повреждённую кожу она вызывает раздражение. Полулетальная доза для крыс при оральном приёме составляет 3,73 г/кг.
Источник
Капля — раствор — хлорное железо
К 0 5 — 1 мл раствора пирогаллола добавляют одну каплю раствора хлорного железа.
В пробирку наливают около 1 мл раствора пирокатехина и добавляют каплю раствора хлорного железа. Появляется характерная зеленая окраска.
К раствору 0 4 г фенола в 50 мл воды добавляют каплю раствора хлорного железа. Приготовленный таким образом реактив U f f e I m a n п а изменяет от молочной кислоты свою голубую окраску на желтую.
В пробирку вводят 2 капли раствора салициловой кислоты и прибавляют 1 каплю раствора хлорного железа. Раствор окрашивается в темно-фиолетовый цвет, что указывает на наличие в салициловой кислоте феноль-ного гидроксила.
К полученному отгону добавляют 1 — 2 капли воды и 1 каплю раствора хлорного железа. Появляется характерное фиолетовое окрашивание.
В пробирку вводят 2 капли раствора салициловой кислоты и прибавляют 1 каплю раствора хлорного железа. Раствор окрашивается в темно-фиолетовый цвет, что указывает на наличие в салициловой кислоте фенольного гид-роксила.
К 1 — 2 мл водного раствора пикриновой кислоты добавляют 1 каплю раствора хлорного железа и отмечают, изменилась ли окраска смеси.
В другую пробирку наливают около 1 мл раствора адреналина и добавляют каплю раствора хлорного железа. Наблюдается зеленая окраска, вследствие наличия остатка пирокатехина, входящего в молекулу адреналина.
Раствор крупинки железосинеродистого калия в 10 мл воды, к которому прибавлена 1 капля раствора хлорного железа, не должен немедленно давать синего окрашивания при прибавлении.
Кристаллик железо-синеродистого калия растворяют в 10 мл воды, прибавляют к раствору одну каплю раствора хлорного железа и затем 1 мл 1 / 0-го раствора хлористоводородного героина.
Наливают в другую пробирку около 1 мл этилового эфира ацетоуксусной кислоты и одну каплю раствора хлорного железа. Появляется фиолетово-красное окрашивание, которое от добавления ( по каплям) бромной воды сначала исчезает, а потом через некоторое время снова появляется.
Нагретый до 100 раствор сантонина в 50 % — ной серной кислоте окрашивается каплей раствора хлорного железа в кроваво-красный цвет.
Помещают в пробирку 2 капли раствора фенола, добавляют 3 капли воды и 1 каплю раствора хлорного железа. Появляется интенсивное красно-фиолетовое окрашивание. Эта реакция служит для качественного открытия фенолов.
Помещают в пробирку 2 капли раствора фенола, добавляют 3 капли воды и 1 каплю раствора хлорного железа. Появляется интенсивное красно-фиолетовое окрашивание.
Восстановление считают законченным, если капля эфирного раствора, разбавленная спиртом, не окрашивается при добавлении капли раствора хлорного железа.