Разведение огня марганцовкой с глицерином
Перманганат калия и глицерин можно хранить в походной аптечке. Перманганат калия обычно берут для приготовления антисептических растворов, а глицерин — для различных косметических и некоторых других медицинских процедур.
Глицерин для разжигания огня должен быть безводным или по крайней мере содержать минимальное количество воды.
Для того, чтобы получить огонь этим методом, необходимо на перманганат калия капнуть несколько капель глицерина. Через некоторое время смесь прореагирует с выделением дыма, а затем загорится. Выглядит это так:
Меры безопасности при использовании этого метода:
- Избегать попадания марганцовки на кожу, слизистые (возможны ожоги) и на одежду (могут остаться пятна).
- Не тушить такой огонь водой. Попадание воды способствует разбрызгиванию смеси.
- Добывать огонь таким путем следует на открытом воздухе, так как перегревание глицерина способствует выделению акролеина — отравляющего вещества 1-го класса опасности.
То же самое вещество выделяется при подгорании жира при приготовлении пищи.
Ссылки
- Katryniok B. и др. (2010). «Дегидратация глицерина в акролеин в контексте новых применений глицерина» Green Chem.12: 2079-2098.
- Гупта, М. и Кумар Н., (2012) «Сфера и возможности использования глицерина в качестве источника энергии» Обзоры возобновляемой и устойчивой энергии 16 (7): 4551-56
- Национальный институт безопасности и гигиены труда (2016). Глицерин: (туман) Получено 2017-04-15 из https://www.cdc.gov/niosh/npg/npgd0302.html
- Ассоциация мыла и моющих средств (1990). Глицерин: обзор получен 2017-04-15 с http://www.aciscience.org/docs/Glycerine_-_an_overview.pdf
Жесткое окисление
Жесткими называют процессы окисления, протекающие в нейтральном растворе в условиях повышенной температуры, а также при добавлении кислоты или щелочи. В этих случаях двойная связь в алкене разрушается полностью, а продуктами реакции становятся кетоны, кислоты (с промежуточным окислением до альдегида) либо соли.

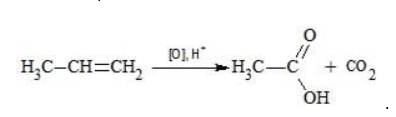
Окисление перманганатом калия в кислой среде
Пропен в содержащем кислоту растворе реагирует до образования уксусной кислоты и углекислого газа:
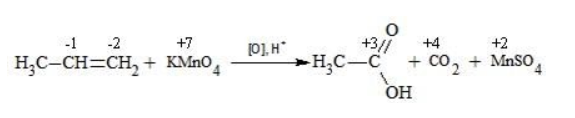
Степени окисления участвующих в реакции углеродных атомов и марганца составят:
Электронный баланс определяется только с учетом углерода, вошедшего в состав кислоты:
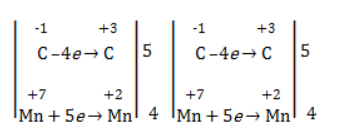
Сначала расставляются коэффициенты в окислителе, восстановителе и в продуктах окисления:
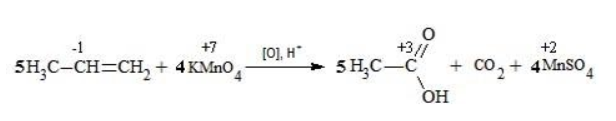
Затем вписываются недостающие вещества и полностью рассчитываются коэффициенты:
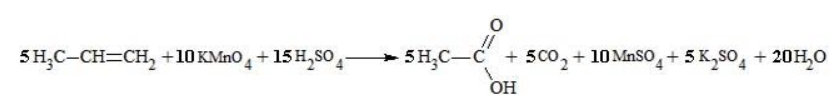
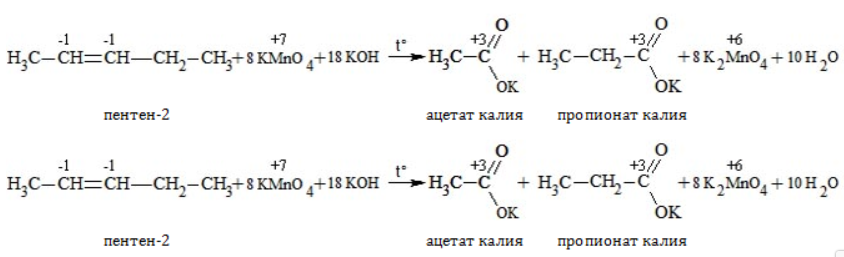
Еще один пример жесткого окисления алкенов перманганатом калия с серной кислотой – реакция с участием пентена-2. Молекула расщепляется по месту двойной связи, и ее фрагменты окисляются через промежуточное образование альдегидов до двух кислот:
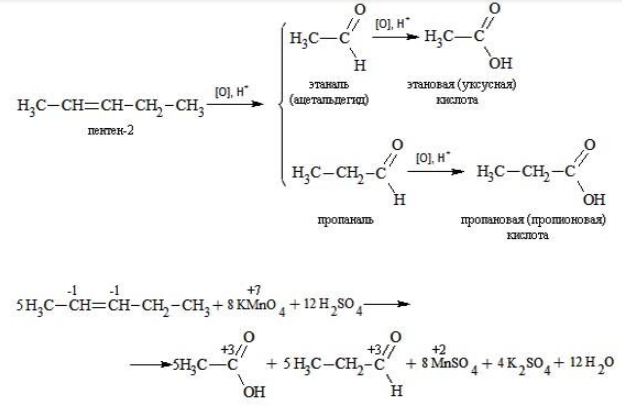
Электронный баланс составляется для двух углеродных атомов алкена, поскольку оба они являются восстановителями.
Правило, по которому осуществляется окисление углерода, отражено в таблице:

Так, в 2-метилпропене первичный атом окисляется через промежуточные формальдегид (метаналь) и муравьиную кислоту полностью – до углекислого газа, а третичный – только до ацетона:
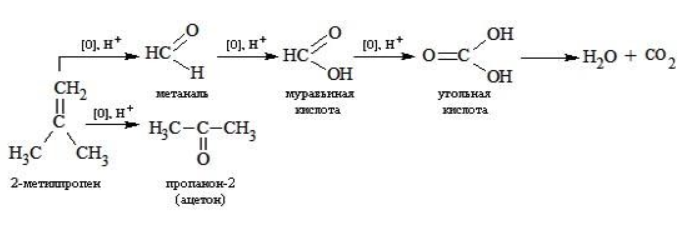
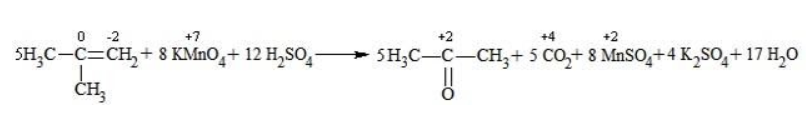
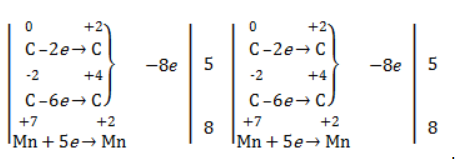
Окисление алкенов в щелочной среде
При нагревании с концентрированной щелочью алкены окисляются до солей:
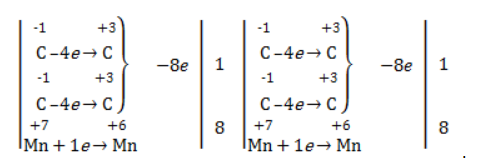
Если один из углеродных атомов – первичный, он окисляется до углекислого газа:

Окисление в нейтральном растворе
В условиях высокой температуры образующаяся щелочь вступает в реакцию, в результате которой окисление алкенов продолжается до образования кетонов или солей. Так, при жестком окислении пропена в нейтральной среде получаются те же продукты, что и в присутствии концентрированного гидроксида калия: ацетат и неорганические соли калия – карбонат и манганат .
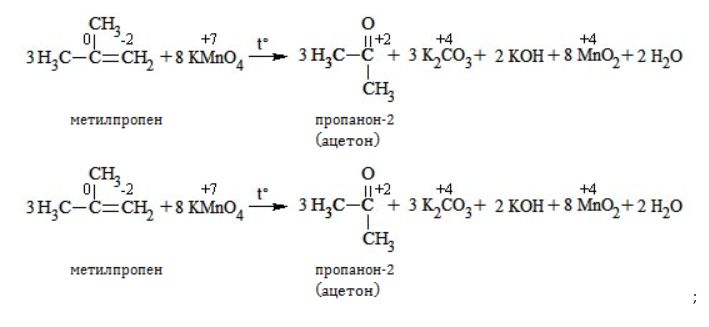
Кетон – результат окисления третичного углеродного атома, и дальнейшую реакцию они не поддерживают. Например, при окислении метилпропена как конечный продукт образуется ацетон:
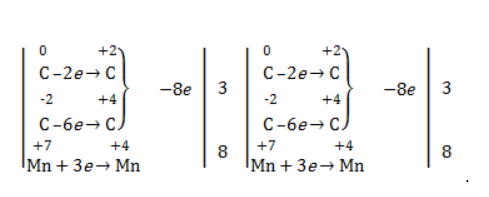
Новое время требует новых решений
Похожая ситуация произошла и в другой области применения глицерина, как компонента охлаждающей жидкости. При разбавлении водой он может не замерзнуть до -40 ° C, но его использование в сложных механизмах вызывает ряд вопросов.
Антифриз на основе глицерина часто оставался слишком вязким и недостаточно текучим. Они пытались исправить это, разбавляя его этанолом и метанолом, но в конце концов, в 1930-х годах даже глицерин был заменен этиленгликолем, как более удобный и экономичный вариант.
Хотя продукты глицерин-метанол все еще присутствуют на рынке хладагентов, эксперты активно не рекомендуют их использовать. Главный аргумент — вязкость растворов с глицерином не может обеспечить необходимую циркуляцию в механизмах, что может привести к перегреву агрегатов. Этот вид антифриза подвержен коррозии при длительном использовании.
Глицерин гораздо более распространен в современной косметике и индустрии бытовой химии, где он используется в кремах, мыле и шампунях. Кроме того, вещество активно используется в пищевой промышленности как стабилизатор — пищевая добавка Е422, позволяющая увеличить срок хранения продукта. В небольших количествах это совершенно безвредная добавка для здоровья человека.
Гигроскопичность глицерина позволяет использовать его в производстве табака для регулирования влажности продуктов. В последнее время помимо бумажных сигарет все большую популярность приобретают электронные сигареты, в основе которых лежат растворы глицерина. Также к сферам его применения относятся текстильная, фармацевтическая, текстильная и кожевенная, бумажная и лакокрасочная промышленность.
структура
Компоненты фосфоглицерида
Фосфоглицерид состоит из четырех основных структурных элементов. Первый — это скелет, который соединен жирными кислотами, фосфатом и спиртом, а последний связан с фосфатом..
Скелет фосфоглицеридов может быть образован из глицерина или сфингозина. Первый представляет собой трехуглеродный спирт, а второй — еще один спирт с более сложной структурой..
В глицерине гидроксильные группы, расположенные на углероде 1 и 2, этерифицированы двумя карбоксильными группами с большими цепями жирных кислот. Недостающий углерод, находящийся в положении 3, этерифицируется фосфорной кислотой.
Хотя глицерин не имеет асимметричного углерода, альфа-углерод не является стереохимически идентичным. Таким образом, этерификация фосфата в соответствующем углероде придает асимметрии молекуле.
Характеристика жирных кислот в фосфоглицеридах
Жирные кислоты представляют собой молекулы, состоящие из углеводородных цепей различной длины и степени ненасыщенности, и заканчиваются карбоксильной группой. Эти характеристики значительно различаются, и определяют их свойства.
Цепь жирных кислот является линейной, если она имеет насыщенный тип или если она ненасыщена в положении транс. Напротив, наличие двойной связи типа цис создает скручивание в цепочке, поэтому больше нет необходимости представлять его линейно, как это обычно делается.
Жирные кислоты с двойными или тройными связями оказывают существенное влияние на состояние и физико-химические характеристики биологических мембран..
Гидрофобные и гидрофильные свойства
Каждый из упомянутых элементов отличается своими гидрофобными свойствами. Жирные кислоты, будучи липидами, являются гидрофобными или неполярными, что означает, что они не смешиваются с водой.
Напротив, остальные элементы фосфолипидов позволяют им взаимодействовать в окружающей среде благодаря их полярным или гидрофильным свойствам..
Таким образом, фосфоглицериды классифицируются как амфипатические молекулы, что означает, что один конец является полярным, а другой — неполярным..
Мы можем использовать аналогию матча или матча. Головка спички представляет собой полярную головку, состоящую из заряженного фосфата и замещений фосфатной группы. Расширение спички представлено неполярным хвостом, образованным углеводородными цепями.
Полярные природные группы заряжаются при рН 7 с отрицательным зарядом. Это связано с явлением ионизации фосфатной группы, которая имеет рк близко к 2, и к нагрузкам этерифицированных групп. Количество зарядов зависит от типа изучаемого фосфоглицерида.
Свойства глицерина
Чистый глицерин имеет температуру плавления 17,8 ° С. Его температура кипения составляет 290 ° C, но он также разлагается при этой температуре. Наличие трех гидроксильных групп делает соединение гигроскопичным с тенденцией поглощать влагу из воздуха. Это также делает его полезным в качестве увлажнителя в косметике и еде, удерживая воду и предотвращая высыхание вещества.
Глицерин легко растворим в воде благодаря способности полиольных групп образовывать водородные связи с молекулами воды. Глицерин немного плотнее воды с удельным весом 1,26. Это означает, что когда глицерин наливается в емкость с водой, он опускается на дно. Однако из-за его растворимости со временем и при слабом перемешивании глицерин образует водный решение.
Глицерин может вызвать легкое раздражение глаза, нос, легкие и кожа особенно из-за его гигроскопической природы. Кожа и другие внутренние органы могут высохнуть, когда чистый глицерин вступает в контакт с этими влажными тканями. Поскольку молекула может связываться с водой, то же свойство, которое делает глицерин хорошим увлажнителем, также высушивает внутренние ткани. С другой стороны, если на кожу наносится косметический препарат с высоким содержанием воды, особенно в засушливых условиях, присутствие глицерина может помешать быстрому высыханию лосьона, крема или геля.
Три гидроксильные группы глицерина позволяют реакциям со многими органическими кислотами образовывать сложные эфиры. Когда все три реакционноспособные группы этерифицированы с помощью длинноцепочечных органических жирных кислот, образуется триглицерид. Триглицериды являются одними из самых распространенных липидов в организме человека.
Использование глицерина
Глицерин используется в ряде промышленных применений, в фармацевтической промышленности, в косметике и средствах личной гигиены, в производстве смол, моющих средств, пластмасс и табака, а также в качестве увлажнителя в пищевых продуктах.
Его использование в качестве коммерчески важного химического вещества началось с его применения в производстве динамита. Динамит был необходим при открытии и добыче подземных полезных ископаемых, а также при строительстве инфраструктуры
Поэтому это стимулировало промышленное развитие.
Косметика и еда
Глицерин используется в косметической промышленности в качестве реагента для контроля влажности и для улучшения текстуры лосьонов и кремов. Способность глицерина удерживать влагу и его смягчающие свойства делают его привлекательным ингредиентом во многих увлажняющих составах. Глицерин также может предотвратить высыхание или замерзание косметики.
В пище полезность глицерина обусловлена его способностью образовывать межмолекулярные водородные связи, особенно с молекулами воды. Это увеличивает содержание воды в консервированных продуктах без ущерба для срока годности, а также повышает вязкость и текстуру. Его низкий токсичность и отсутствие неприятного запаха или аромата позволяют использовать глицерин в качестве эмульгатора.
Промышленные применения
Сырой глицерин является побочным продуктом производства биотоплива из соевого масла и других растительных масел. Содержит более 60% примесей в форме метанол, мыло и соли, что затрудняет извлечение чистого глицерина. Последние достижения в технологии позволяют использовать сырой глицерин для получения пенополиуретанов. Пенополиуретаны имеют множество применений в строительной и автомобильной промышленности. Они также широко используются в качестве изоляторов.
Чистый глицерин является важной частью промышленного производства антифриза, текстиля и восков. Он используется в больших количествах для производства смол, красок и восков, для создания чистящих и чистящих средств для пайки, а также в производстве многих текстильных и косметических средств
Фармацевтические препараты
Использование глицерина в фармацевтической промышленности для улучшения гладкости и вкуса. Он используется при создании таблеток, чтобы их было легко проглотить. Покрытие может распасться внутри тела. Леденцы от кашля часто используют глицерин, чтобы дать сладкий вкус. Суппозитории глицерина могут действовать как слабительные, так как они могут раздражать слизистую оболочку анального отверстия.
Производство триацетина
Триацетин представляет собой тройной эфир глицерина, образующийся в результате реакции этерификации с уксусная кислота, Он используется в пищевой промышленности в качестве пластификатора для повышения вязкости продукта. Он также может выступать в качестве стабилизатора для пищевых продуктов, которые необходимо хранить в течение длительных периодов времени.
Триацетин используется в качестве антидетонационного реагента в топливе для двигателей внутреннего сгорания. Это также добавка в сигареты.
Влияние среды на окислитель
Состав раствора (наряду с температурой) определяет, до какого соединения окислится восстановитель – алкен. Окислитель в растворах с различным уровнем кислотности (щелочности) также ведет себя неодинаково.
Неорганическая соль в водном растворе диссоциирует на катион металла и собственно окислитель – перманганат-анион . В ходе реакции марганец восстанавливается от степени окисления +7 +7 до той или иной величины в зависимости от среды.
В нейтральной и слабощелочной среде марганец приобретает степень окисления +4 +4:
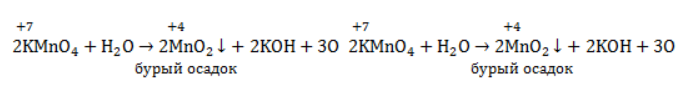
Кислород из перманганат-аниона присоединяется к алкену по месту двойной связи.
Под воздействием серной кислоты марганец восстанавливается до степени окисления +2 +2:
При окислении со щелочью (гидроксид лития достаточно высокой концентрации) марганец восстановится до +6 +6:
Разведение огня марганцовкой с сахаром
Этот способ, как по мне, более универсален для туристов, нежели предыдущий, так как в отличии от глицерина, сахар с собой берет большинство любителей активного отдыха в дикой природе. Хотя на самом деле можно обойтись и вовсе без сахара, используя только марганцовку, но мы рассмотрим наиболее известный в народе вариант.
Алгоритм получения огня данным способом следующий:
- Берется легковоспламеняющийся трут, например, вата или сухая трава.
- Из сухой, но прочной ветки делается небольшая палочка и заостряется на конце.
- В бревне или деревянной дощечке вырезается небольшое углубление по диаметру поперечного сечения заготовленной палочки.
- Острие палочки помещается в углубление и притирается.
- Марганцовка смешивается с сахаром в пропорции 9:1 и помещается в углубление.
- Смесь придавливается палочкой к дну углубления, а над ним по периметру располагается трут.
- Растирание смеси марганцовки с сахаром дает вспышку, которая приводит к возгоранию трута. Но, как уже было сказано, использование сахара в этом способе не обязательно: лучше оставить его для гастрономических целей.
ВНИМАНИЕ! Заготавливать заранее и хранить готовые смеси с марганцовкой недопустимо: такие смеси благодаря сильным окислительным способностям перманганата калия могут самовоспламеняться или взрываться. Не носите в рюкзаке уже смешанные марганцовку и сахар — такой розжиг можно готовить только непосредственно перед разведением костра
При использовании данного метода добычи огня без спичек следует помнить, что во время вспышки излишки перманганата калия могут разлетаться в стороны, попадая на человека и его одежду.
Если под руками имеется только марганцовка без сахара, огонь можно развести так, как показано на видео ниже:
Вообще, перманганат калия в походе — вещь необходимая, причем не только для разведения костра. Его можно использовать для обеззараживания воды, для лечения отравления некоторыми алкалоидами, для промывания ран и, как можем убедиться, для добычи огня. Поэтому имеет смысл приобрести марганцовку и носить ее не только в аптечке, но и в НАЗе. Я, например, ношу небольшое количество марганцовки в своем браслете из репшнура: там она запаяна в герметичный гибкий контейнер и находится между переплетениями шнура.
Напечатать
Окисление глицерина перманганатом калия
Задача 48.
Напишите три уравнения реакций окисления многоатомных спиртов на примере глицерина перманганатом калия.Решение:1. Окисление глицерина перманганатом калия
Процесс окисления многоатомных спиртов происходит ступенчато. При жестком окислении глицерина перманганатом в присутствии ионов Н+ (концентрированная серная кислота при нагревании) возможно окисление первичных спиртовых групп до карбоксильных (-СООН), а вторичных — до кетонных (=О):
СН2(ОН)СН(ОН)СН2(ОН) + 2KMnO4 + 3H2SO4 → СООНС(О)СООН + 2MnSO4 + К2SO4 + 6H2O
Реакция протекает через несколько стадий и при этом образуется конечное вещество: СООНС(О)СООН — 2-оксопропандиовая кислота (диоксипропандиовая кислота)) или
2-оксомалоновая кислота (диоксималоновая кислота) , а также
2-оксометандикарбоновая кислота.
Водный раствор диоксипропандиовой кислоты называется мезоксалевой кислотой:
СООН(СО)СООН + H2O = СООНС(ОН)2СООН
2. Реакция Карла Шееле
При смешивании глицерина с кристаллическим перманганатом калия (марганцовкой) происодит бурная реакция ( яркая вспышка смеси). Взаимодействие сопровождается выделением большого количества теплоты и газов (углекислый газ СО2 и пары воды Н2О), которые увлекают за собой горячие твердые частицы диоксида марганца МnО2 и карбоната калия К2CO3:
14КМnО4 + 3С3Н5(ОН)3 = 7K2CO3 + 14MnO2 + 12H2O + 2CO2
3. Глицерин при взаимодействии с перманганатом калия КMnО4 в присутствии H2SO4 возможно окисление по реакции:
5СН2(ОН)СН(ОН)СН2(ОН) + 14КMnО4 + 21H2SO4 = 15CO2 + 14MnSO4 + 7K2SO4 + 41H2O
Получение 1,2-дийодперфторбутана
Задача 49.
Рассчитайте загрузку иода на первую стадию процесса, при условии, что расчет надо вести на C4F8J2. Заполнение реактора 80% при максимальной температуре процесса 230°С. Реактор V = 2л.Решение:
I2 ⇔ 2I•
CF2=CF2 + I• ⇔ CF2I– CF2•
CF2I– CF2• + I• ⇔ CF2I– CF2I
Процесс начинается с термодиссоциации иода с образованием атомарного иода, который вступает в реакцию с тетрафторэтилена (ТФЭ) с образованием тетрафторэтилиодидного радикала, который стабилизируется за счет присоединения атома иода с образованием 1,2-дииодперфторэтана (ДИЭ).
Процесс образования 1,2-дийодперфторбутана из дийодперфторэтана и тетрафторэтилена (ТФЭ) может быть описан следующими уравнениями:
ICF2–CF2I ⇔ ICF2–CF2• + I• (1)
ICF2–CF2• + CF2=CF2 ⇔ ICF2–CF2–CF2–CF2• (2)
ICF2–CF2–CF2–CF2• + I• > ICF2–CF2–CF2–CF2I (3)
Из уравнений реакций вытекает, что на образование 1 моль C4F8J2 затрачивается 1 моль I2, т.е n(I2) = n(C4F8J2).
Рассчитаем количество C4F8J2:
n(C4F8J2) = V(C4F8J2)/Vm = /Vm = (2 . O,8)/22,4 = 0,0714 моль.
Тогда
n(I2) = n(C4F8J2) = 0,0714 моль.
Отсюда
m(I2) = n(I2) . M(I2) = 0,0714 . 253,8089 = 18,12 г.
Ответ: m(I2) = 18,12 г.
Нахождение состава смеси метана и этана
Задача 50.
При сжигании 20 л смеси метана и этана добыто 25 л карбон (IV) оксида. Найти состав смеси в обьемных частях.Решение:
Уравнения реакции горения веществ будут иметь вид:
1) CH4 + O2 = CO2 + 2H2O
2) C2H6 + 3,5O2 = 2CO2 + 3H2O
Из уравнений горения газов вытекает, что при сгорании 1 моль метана образуется 1 моль углекислого газа, а при сгорании этана — 2 моль.
Примем объм метана и этана в газовой смеси за «х» и «у» соответственно, а объёмы СО2 — Х и 2Y.
Для вычисления состава смеси метана и этана в обьемных частях составим уравнение с двуья паременными, плоучим:
х + у = 20х + 2у = 25
Решим систему линейных уравнений методом подстановки:
Выразим из первого уравнения х + у = 20 данной системы «y» через «x», получим:
у = (20 — х).
Подставив во второе уравнение х + 2у = 25 данной системы вместо «y» выражение (20 — х), получим систему:
х + у = 20х + 2(20 — х) = 25
Полученные системы равносильны. В последней системе второе уравнение содержит только одну переменную. Решим это уравнение, получим:
х + 2(20 — х) = 25х + 40 — 2х = 25
«х» = 15
Тогда «у» = 20 — «х» = 20 — 15 = 5.
Ответ: V(CH4) = 15 л; V(C2H6) = 5 л.
Вред для организма и меры безопасности
Если человек использует лекарства или косметические средства, содержащие глицерин, он должен сначала узнать об опасности этого вещества, а также в каких случаях его не следует использовать.
При применении средства в домашних условиях без наблюдения или назначения специалиста у человека могут возникнуть побочные эффекты или обезвоживание организма:
При приеме пероральных препаратов пациенты иногда испытывают головокружение, тошноту, рвоту, вздутие живота, головную боль, жажду или диарею.
Люди часто испытывают сухость во рту, частое мочеиспускание или диарею после внутривенного применения препарата
Такие симптомы могут привести к обезвоживанию организма, поэтому лечение назначается с большой осторожностью.
Нет данных о влиянии глицерина на беременных и кормящих женщин при пероральном или внутривенном приеме. В этом случае от лечения стоит отказаться, чтобы избежать негативных последствий.
Поскольку растительное вещество обычно получают из кокосового или пальмового масла, в отдельных случаях оно вызывает аллергическую реакцию.
Чистая гигроскопичная жидкость губительно действует и при попадании на язык вызывает ожоги.
Курильщики электронных сигарет часто страдают от сухости во рту и боли в горле
Эти устройства содержат глицерин, который при вдыхании «собирает» влагу, что пагубно сказывается на состоянии легких человека. Не рекомендуется испарять аптечный глицерин. Специалисты советуют использовать только пищевой вариант.
Препараты с органическими соединениями применять согласно инструкции на упаковке. Некоторые лекарства, содержащие это вещество, перед применением необходимо взболтать. Если глицерин используется для увлажнения и смягчения кожи или для лечения опрелостей, его необходимо наносить после каждого мытья рук.
Следует соблюдать осторожность, чтобы избежать контакта с глазами, ртом и носом. После лучевой терапии для лечения ожогов кожи желательно проконсультироваться с врачом по поводу приема вещества
функции
Структура биологических мембран
Липиды представляют собой гидрофобные биомолекулы, которые имеют растворимость в растворителях органического типа, таких как, например, хлороформ..
Эти молекулы имеют широкий спектр функций: выполнять роль топлива, аккумулируя концентрированную энергию; в качестве сигнальных молекул; и как структурные компоненты биологических мембран.
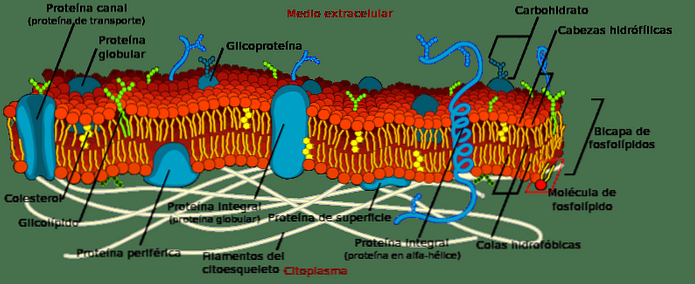
В природе наиболее распространенной группой липидов, которые существуют, являются фосфоглицериды. Его основная функция носит структурный характер, поскольку они являются частью всех клеточных мембран..
Биологические мембраны сгруппированы в двухслойную форму. Это означает, что липиды сгруппированы в два слоя, где их гидрофобные хвосты смотрят внутрь бислоя, а полярные головки дают наружу и внутри клетки.
Эти структуры имеют решающее значение. Они разграничивают клетки и отвечают за обмен веществ с другими клетками и с внеклеточной средой. Однако мембраны содержат молекулы липидов, отличных от фосфоглицеридов, а также молекулы белковой природы, которые обеспечивают активный и пассивный транспорт веществ..
Вторичные функции
Помимо того, что они являются частью биологических мембран, фосфоглицериды связаны с другими функциями в клеточной среде. Некоторые очень специфические липиды являются частью миелиновой оболочки, вещества, которое покрывает нервы.
Некоторые могут выступать в качестве сообщений при захвате и передаче сигналов в сотовую среду..
Метаболизм
Глицерин является предшественником для синтеза триацилглицеринов и фосфолипидов в печень и жировая ткань. Когда организм использует накопленный жир в качестве источника энергии, глицерин и жирные кислоты попадают в кровоток.
Глицерин метаболизируется в основном в печени. Инъекции глицерина можно использовать в качестве простого теста на повреждение печени, поскольку скорость его поглощения печенью считается точным показателем здоровья печени. Метаболизм глицерина снижается как при циррозе, так и при жировой болезни печени.
Уровни глицерина в крови сильно повышаются во время диабета и, как полагают, являются причиной снижения фертильности у пациентов, страдающих диабетом и метаболическим синдромом. Уровни глицерина в крови у пациентов с диабетом в среднем в три раза выше, чем у здоровых людей. Было обнаружено, что прямая обработка семенников глицерином вызывает значительное долгосрочное снижение количества сперматозоидов. Дальнейшие испытания по этому предмету были прекращены из-за неожиданных результатов, поскольку это не было целью эксперимента.
Циркулирующий глицерин не гликирует белки, как глюкоза или фруктоза, и не приводят к образованию конечных продуктов гликирования (AGE). У некоторых организмов глицериновый компонент может напрямую вступать в путь гликолиза и, таким образом, обеспечивать энергию для клеточного метаболизма (или, потенциально, превращаться в глюкозу посредством глюконеогенеза).
Прежде чем глицерин сможет вступить в путь гликолиза или глюконеогенеза (в зависимости от физиологических условий), он должен быть преобразован в их промежуточное соединение глицеральдегид-3-фосфат на следующих этапах:
Фермент глицеринкиназа присутствует в основном в печень и почки, но также и другие ткани организма, включая мышцы и мозг. В жировой ткани глицерин-3-фосфат получают из дигидроксиацетонфосфата (DHAP) с помощью фермента глицерин-3-фосфатдегидрогеназа.
. Глицерин имеет очень низкую токсичность при приеме внутрь; его LD50 пероральная доза для крыс составляет 12600 мг / кг и 8700 мг / кг для мышей. По-видимому, он не вызывает токсичности при вдыхании, хотя изменения в зрелости клеток произошли в небольших участках легких у животных при максимальной измеренной дозе. Субхроническое 90-дневное исследование ингаляции только через нос на крысах Sprague-Dawley (SD), подвергавшихся воздействию 0,03, 0,16 и 0,66 мг / л глицерина (на литр воздуха) в течение 6-часовых непрерывных сеансов, не выявило связанной с лечением токсичности. чем минимальная метаплазия эпителиальной выстилки в основании надгортанника у крыс, подвергшихся воздействию глицерина 0,66 мг / л.
ссылки
- Berg, J.M., Stryer L., & Tymoczko, J.L. (2007). биохимия. Я поменял.
- Девлин Т. М. (2004). Биохимия: учебник с клиническими приложениями. Я поменял.
- Федучи Е., Бласко И., Ромеро С. С. и Яньес Е. (2011). Биохимия. Основные понятия. ПанамериканаЛ.
- Мело В., Руис В. М. и Куамати О. (2007). Биохимия метаболических процессов. Реверте.
- Nagan, N. & Zoeller, R.A. (2001). Плазмалогены: биосинтез и функции. Прогресс в исследованиях липидов, 40(3), 199-229.
- Pertierra, A.G., Olmo, R., Aznar, C.C. & Lopez, C.T. (2001). Метаболическая биохимия. Редакция Тебар.
- Voet, D., Voet, J.G. & Pratt, C.W. (2014). Основы биохимии. Artmed Publisher.
Физические и теплофизическине свойства водных растворов глицерина
Плотность водного раствора глицерина в зависимости от температуры и концентрации. Таблица.
Плотность смеси глицерина и воды указана в таблице для концентрации глицерина от 10% до 70% по весу в диапазоне температур от нуля до ста градусов Цельсия.
| Температура, ° C | Плотность водного раствора глицерина (содержание в процентах по массе) /, г / см3 | ||||||
| 10% | ветры% | тридцать% | 40% | 50% | 60% | 70% | |
| 1.025 | 1.052 | 1.079 | 1,107 | 1.135 | 1,163 | 1,192 | |
| ветры | 1.022 | 1047 | 1.073 | 1,099 | 1,126 | 1.154 | 1,181 |
| 40 | 1.016 | 1,039 | 1,064 | 1.089 | 1,115 | 1.142 | 1,169 |
| 60 | 1,006 | 1.030 | 1.053 | 1,078 | 1,103 | 1.130 | 1,156 |
| 80 | 0,994 | 1.017 | 1.041 | 1,066 | 1,091 | 1.117 | 1,144 |
| 100 | 0,982 | 1,004 | 1.027 | 1.052 | 1.077 | 1,104 | 1,302 |
Вязкость водного раствора глицерина указана в таблице в диапазоне температур смеси от нуля до ста градусов Цельсия, а концентрация глицерина от 10% до 70%. Интересно отметить, что добавление всего 10% (по весу) глицерина в воду позволяет увеличить динамическую вязкость раствора на 30%.
| Температура, ° C | Абсолютная вязкость (динамическая) водного раствора глицерина (массовая доля) μ, Па * с | ||||||
| 10% | ветры% | тридцать% | 40% | 50% | 60% | 70% | |
| 2,44 * 10-3 | 3,44 * 10-3 | 5,14 * 10-3 | 8,25 * 10-3 | 14,6 * 10-3 | 29,9 * 10-3 | 76,0 * 10-3 | |
| ветры | 1,31 * 10-3 | 1,76 * 10-3 | 2,5 * 10-3 | 3,72 * 10-3 | 6,0 * 10-3 | 10,8 * 10-3 | 22,5 * 10-3 |
| 40 | 0,826 * 10-3 | 1,07 * 10-3 | 1,46 * 10-3 | 2,07 * 10-3 | 3,10 * 10-3 | 5,08 * 10-3 | 9,4 * 10-3 |
| 60 | 0,575 * 10-3 | 0,731 * 10-3 | 0,956 * 10-3 | 1,30 * 10-3 | 1,86 * 10-3 | 2,85 * 10-3 | 4,86 * 10-3 |
| 80 | — | — | 0,69 * 10-3 | 0,918 * 10-3 | 1,25 * 10-3 | 1,84 * 10-3 | 2,9 * 10-3 |
| 100 | — | — | — | 0,668 * 10-3 | 0,91 * 10-3 | 1,28 * 10-3 | 1,93 * 10-3 |
Значения теплопроводности водного раствора глицерина приведены в таблице для диапазона температур от 20 до 80 градусов Цельсия и концентрации глицерина от 10% до 70%. С увеличением концентрации глицерина теплопроводность водного раствора снижается. При содержании глицерина 50% теплопроводность смеси примерно на 29% ниже, чем у чистой воды.
| Температура | Теплопроводность смеси глицерина (содержание в процентах по массе) с водой Вт / (м * ° C) | ||||||
| 10% | ветры% | тридцать% | 40% | 50% | 60% | 70% | |
| ветры | 0,557 | 0,519 | 0,481 | 0,448 | 0,414 | 0,381 | 0,352 |
| 40 | 0,586 | 0,540 | 0,502 | 0,460 | 0,423 | 0,385 | 0,356 |
| 60 | 0,611 | 0,565 | 0,519 | 0,477 | 0,435 | 0,393 | 0,360 |
| 80 | 0,636 | 0,590 | 0,540 | 0,494 | 0,448 | 0,402 | 0,364 |
В таблице приведены расчетные значения теплоемкости водного раствора глицерина для температур от 20 до 80 градусов Цельсия и концентрации глицерина от 10 до 70%. С увеличением концентрации глицерина теплопроводность раствора снижается. При нормальных условиях и при содержании глицерина 10% теплоемкость смеси примерно в 2 раза ниже теплоемкости чистой воды.
| Температура, ° С | Теплоемкость смеси глицерина (массовая доля) с водой кДж / (кг * ° C) | ||||||
| 10% | ветры% | тридцать% | 40% | 50% | 60% | 70% | |
| ветры | 1,998 | 1 907 | 1816 | 1,725 | 1,634 | 1,542 | 1,452 |
| 40 | 2 002 | 1 916 | 1830 | 1,744 | 1,659 | 1,573 | 1,487 |
| 60 | 2,010 | 1,929 | 1848 | 1,767 | 1,687 | 1 606 | 1,525 |
| 80 | 2,024 | 1 948 | 1871 | 1,795 | 1,718 | 1,642 | 1 608 |
Концентрация глицерина по массе и по объёму в водном растворе
В следующей таблице показано соотношение между концентрацией глицерина в водном растворе по весу и по объему.
| Концентрация глицерина в водном растворе по весу | 5% | 10% | ветры% | тридцать% | 40% | 50% | 60% | 70% |
| Концентрация глицерина в водном растворе по объему | 4,0% | 8,1% | 16,58% | 25,49% | 34,84% | 44,63% | 54,86% | 65,56% |
Температура кипения смеси глицерина с водой (при нормальном атмосферном давлении)
- Вода (без глицерина): 100 ° C
- Вода (90%) + глицерин (10%): 100,7 ° C
- Вода (70%) + глицерин (30%): 102,9 ° C
- Вода (50%) + глицерин (50%): 106,7 ° C
- Глицерин (80%) + вода (20%): 121,5 ° C
- Глицерин (90%) + вода (10%): 139,8 ° C
- Глицерин (95%) + вода (5%): 168 ° C
Пути метаболизма глицерина. Распад глицерина по пути к углеводам
Глицерин может быть повторно использован для синтеза жира или других липидов. Глицерин может участвовать в обмене углеводов. В любом случае в первую очередь происходит активация глицерина, сходная с активацией углеводов. Если глицерин распадается по пути к углеводам, то происходит дегидрирование. Митохондриальная фосфоглицериндегидрогеназа содержит в качестве небелковой части ФАД, а цитоплазматическая — НАД. В митохондриях отщепляемый водород переносится по укороченной цепи митохондриального окисления, и образуется 2 молекулы АТФ (фосфоглицерин (ФГА) — субстрат укороченной цепи).
Два варианта дальнейших превращений ФГА:
— ФГА может окисляться в ГБФ-пути до СО2 и Н2О с образованием 21 молекулы АТФ;
— ФГА может вступить в реакции гликонеогенеза с образованием углеводов — глюкозы или гликогена.
Жирные кислоты могут вступать в реакции только после активации. Активация жирных кислот принципиально отличается от активации углеводов. Реакция начинается с переноса от АТФ не фосфата, а АМФ, с образованием промежуточного продукта — ациладенилата. Затем с участием HS-KoA отщепляется АМФ, и образуется активная форма любой жирной кислоты — Ацил-КоА.
Образовавшийся АМФ не может превратиться в АТФ. Поэтому протекает еще одна реакция, тоже с затратой АТФ: АМФ + АТФ ——> 2 АДФ. Распад 1 АТФ до АМФ энергетически равен распаду 2 АТФ до 2 АДФ. Поэтому затраты энергии на активацию жирной кислоты составляют 2 АТФ на 1 молекулу жирной кислоты.
Для активной жирной кислоты, как и для глицерина, возможны два пути метаболических превращений:
— синтез жира или других липидов;
— катаболизм до Ацетил-КоА — b-окисление жирных кислот.
Активация ЖК происходит в цитоплазме, а b-окисление — в митохондриях.
Ацил-КоА не может проходить через мембрану митохондрий, поэтому имеется специальный механизм транспорта ЖК из цитоплазмы в митохондрию при участии карнитина. Во внутренней мембране митохондрий есть специальный транспортный белок, обеспечивающий перенос. Благодаря этому ацилкарнитин легко проникает через мембрану митохондрий.
Цитоплазматическая и митохондриальная карнитинацилтрасферазы отличаются друг от друга строением и кинетическими характеристиками. Vmax (скорость) цитоплазматической ацилкарнитинтрансферазы ниже Vmax митохондриального фермента, а также ниже Vmax ферментов b-окисления. Поэтому цитоплазматическая ацилкарнитинтрансфераза — ключевой фермент распада жирных кислот. Если жирная кислота попадает в митохондрию, то она обязательно подвергается катаболизму до Ацетил-КоА.
Свойства вещества
Глицерин — это органическое соединение, получаемое из растительных и животных масел. В нем хорошо растворяются различные вещества. Продукт не относится к токсичным и ядовитым соединениям. На марки дистиллированных веществ распространяется ГОСТ 6824-96 .
Химическая формула глицерина — C3H8O3. В структурной формуле вещество состоит из цепочки из трех атомов углерода, каждый из которых связан с атомом водорода и гидроксильной группой. Глицериновые эфиры длинноцепочечных карбоновых кислот называются триглицеридами. Они являются важными производными в метаболизме живых организмов.
Основные физические свойства глицерина:
- плотность — 1,261 г / см3;
- молярная масса — 92,1 г / моль;
- температура кипения (испарения) — 290 ° C.
В чистом виде вещество не замерзает, поэтому температуру замерзания глицерина определяют исходя из его концентрации в растворах. Простейший представитель трехвалентных спиртов выглядит как прозрачная вязкая жидкость. Его можно смешивать с водой в разных пропорциях. Глицерин отличается сладким вкусом. В сочетании с пропиленгликолем жидкость становится более текучей. Сильно нагретое и воспаленное соединение горит синим пламенем.
Химические свойства вещества характерны для поливалентных спиртов. При взаимодействии с галогенидами водорода или галогенидами фосфора образуются моно- и диалогидрины. С азотной кислотой образуется нитроглицерин, который используется в производстве бездымных порохов.




























