ХИМИЯ
§ 18.2. Общие химические свойства металлов
Атомы металлов сравнительно легко отдают валентные электроны и переходят в положительно заряженные ионы, т. е. окисляются. В этом, как вам известно, заключается главное общее свойство и атомов, и простых веществ — металлов.
Металлы в химических реакциях всегда восстановители. Восстановительная способность атомов простых веществ — металлов, образованных химическими элементами одного периода или одной главной подгруппы Периодической системы Д. И. Менделеева, изменяется закономерно (см. рис. 37).
Восстановительную активность металла в химических реакциях, которые протекают в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов.

(Нижнюю строчку ряда следует рассматривать как продолжение предыдущей.)
Более точное название этого ряда — ряд стандартных электродных потенциалов металлов.
Что такое электродный потенциал? Каким образом составлен названный ряд? Как этим рядом пользоваться?
При погружении любого металла в раствор электролита на границе металл—раствор устанавливается равновесие:
В металле появляется избыток электронов, а раствор на границе заряжается положительно. Таким образом образуется двойной электрический слой и возникает разность потенциалов, называемая электродным потенциалом. Электродный потенциал каждого электрода зависит от природы металла, концентрации его ионов в растворе и температуры.
Абсолютное значение электродного потенциала непосредственно измерить нельзя. Вместе с тем не представляет труда измерение разности электродных потенциалов, которая возникает в системе, состоящей из двух пар металл—раствор. Условились определять электродные потенциалы металлов по отношению к стандартному водородному электроду, потенциал которого принят за нуль. Такой электрод состоит из специально приготовленной платиновой пластинки, которая погружена в раствор серной кислоты с концентрацией ионов водорода, равной 1 моль/л, и омывается струей газообразного водорода под давлением в 101,325 кПа при 25 °С.
Если пластинку любого металла, погруженного в раствор его соли с концентрацией ионов металла 1 моль/л, соединить со стандартным водородным электродом, то получится электрическая цепь (гальванический элемент), электродвижущую силу (ЭДС) которой легко измерить. Эту ЭДС и называют стандартным электродным потенциалом (Е°). Например:
-
-
Е°(К+/К) = -2,92 В,
Е°(Аl3+/Аl) = -1,67 В,
Е°(Fe2+/Fe) = -0,44 В,
Е°(Cu2+/Cu) = +0,34 В,
Е°(Ag+/Ag) = +0,80 В.
-
Е°(К+/К) = -2,92 В,
Металлы, расположенные в порядке возрастания алгебраических величин их стандартных электродных потенциалов, образуют хорошо известный вам электрохимический ряд напряжений металлов.
На основании этого ряда напряжений можно сделать следующие важные заключения о химической активности металлов в реакциях, протекающих в водных растворах при стандартных условиях (t = 25 °С, р = 1 атм):
- Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
- Каждый металл способен вытеснять (восстанавливать) из солей в растворе те металлы, которые в ряду напряжений стоят после него (правее).
- Металлы, находящиеся в ряду напряжений левее водорода, способны вытеснять его из кислот в растворе.
- Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные), в любых водных растворах взаимодействуют прежде всего с водой.
Восстановительная активность металла, определенная по электрохимическому ряду, не всегда соответствует положению его в Периодической системе. Это объясняется тем, что при определении положения металла в ряду напряжений учитывают не только энергию отрыва электронов от отдельных атомов, но и энергию, затрачиваемую на разрушение кристаллической решетки, а также энергию, выделяющуюся при гидратации ионов.
Например, литий более активен в водных растворах, чем натрий (хотя по положению в Периодической системе Na — более активный металл). Дело в том, что энергия гидратации ионов Li+ значительно больше, чем энергия гидратации ионов Na+, поэтому первый процесс является энергетически более выгодным.
Рассмотрев общие положения, характеризующие восстановительные свойства металлов, перейдем к конкретным химическим реакциям.
Общая характеристика металлов
Все химические элементы делятся на металлы и неметаллы. В основе такого деления лежит различие в строении атомов элементов.
Неметаллы в таблице Периодической системы Менделеева занимают правый верхний угол (желтые ячейки на рисунке внизу):
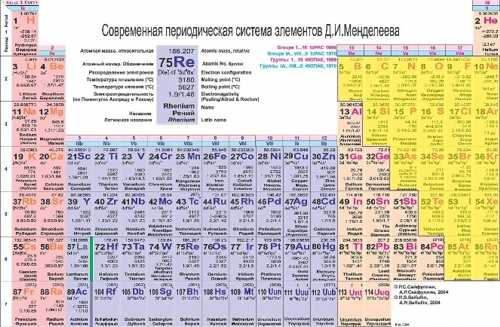
Все остальные, не желтые ячейки плюс водород и гелий — занимают металлы. Таким образом, неметаллы и металлы в Периодической таблице разделены условной диагональю бор-астат.
Химические элементы, расположенные в непосредственной близости от этой диагонали (алюминий, титан, галлий, германий, сурьма, теллур, астат), имеют двойственные свойства, реагируя в некоторых случаях, как металлы, а в других — как неметаллы.
Закономерности расположения элементов в периодах (слева-направо):
- Радиус атома — уменьшается;
- Заряд ядра — увеличивается;
- Электроотрицательность — увеличивается;
- Кол-во электронов на внешнем слое — увеличивается;
- Прочность связи внешних электронов с ядром атома — увеличивается;
- Способность отдавать электроны — уменьшается.
Исходя из вышеуказанных закономерностей, нетрудно догадаться, что металлы находятся в начале каждого периода (слева), а неметаллы — в конце (справа).
Атомы металлов:
- как правило, на внешнем электронном слое имеют 1-3 электрона (4 электрона у Ge, Sn, Pb; 5 — у Sb, Bi; 6 — у Po);
- имеют больший размер атома и меньший заряд его ядра, по сравнению с неметаллами своего периода;
- имеют высокопрочную связь внешних электронов с ядром атома;
- легко расстаются с валентными электронами, превращаясь в катионы.
При н.у. все металлы (за исключением ртути) являются твердыми веществами, обладающими прочной кристаллической решеткой, образованной за счет металлических связей. Между узлами кристаллической решетки находятся свободные электроны, которые могут переносить теплоту и проводить электрический ток. Поэтому, в отличие от неметаллов, металлы хорошо проводят тепло и обладают высокой электропроводностью.
Физические свойства металлов:
- твердые вещества (кроме ртути);
- обладают характерным металлическим блеском;
- обладают высокой электро- и теплопроводностью;
- обладают высокими механическими качествами: упругостью, пластичностью, прочностью.
Самыми мягкими металлами являются калий и натрий (их можно резать ножом), самый твердый металл — хром (царапает стекло).
Самый легкоплавкий металл ртуть (-38,9°C), самый тугоплавкий — вольфрам (3380°C).
Самая низкая плотность у лития (0,59 г/см3), самая высокая — у осмия (22,48 г/см3).
Еще одной характерной особенностью металлов является их способность намагничиваться:
- ферромагнетики обладают высокой способностью намагничиваться даже под действием незначительного магнитного поля (железо, никель);
- парамагнетики проявляются слабую способность к намагничиванию (алюминий, хром);
- диамагнетики не намагничиваются (олово, медь).
Электронные оболочки атомов металлов
Атомы металлов имеют особенности в строении своих электронных оболочек, которые обусловливают их способность отдавать валентные электроны. Внешние электроны, находящиеся на самой высокой энергетической уровне, называются валентными электронами. Число валентных электронов определяется порядковым номером элемента в таблице Менделеева. У атомов металлов в основном степени окисления положительны, так как они легко теряют свои валентные электроны.
В электронной оболочке атомов металлов внутриных электронов достаточно много, и они образуют стабильные электронные конфигурации. Поэтому, чтобы достичь наиболее стабильного состояния, атомы металлов стремятся отдать свои валентные электроны и образовать положительный ион. Это объясняет их способность к донорству электронов в химических реакциях.
Кроме того, атомы металлов часто обладают большими размерами и слабыми силами притяжения между ядром и электронами. Это также способствует их отдаче валентных электронов, так как электроны слабо удерживаются ядром и могут легко двигаться по металлической решетке.
Таким образом, особенности электронных оболочек атомов металлов, а именно большое количество внутренних электронов и слабое взаимодействие с ядром, обуславливают их способность только отдавать валентные электроны и образовывать положительные ионы при взаимодействии с другими элементами.
Внутреннее строение и физические свойства металлов
Металлы — это простые вещества, атомы которых могут только отдавать электроны. Такая особенность металлов связана с тем, что на внешнем уровне этих атомов мало электронов (чаще всего от 1 до 3) или внешние электроны расположены далеко от ядра. Чем меньше электронов на внешнем уровне атома и чем дальше они расположены от ядра, — тем активнее металл (ярче выражены его металлические свойства).
Задание 8.1. Какой металл активнее:
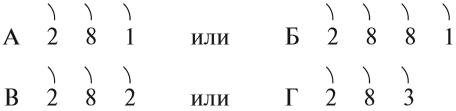
Назовите химические элементы А, Б, В, Г.
Металлы и неметаллы в Периодической системе химических элементов Менделеева (ПСМ) разделяет линия, проведённая от бора к астату. Выше этой линии в главных подгруппах находятся неметаллы (см. урок 3). Остальные химические элементы — металлы.
Задание 8.2. Какие из следующих элементов относятся к металлам: кремний, свинец, сурьма, мышьяк, селен, хром, полоний?
Вопрос. Как можно объяснить тот факт, что кремний — неметалл, а свинец — металл, хотя число внешних электронов у них одинаково?
Существенной особенностью атомов металлов является их большой радиус и наличие слабо связанных с ядром валентных электронов. Для таких атомов величина энергии ионизации* невелика.
Часть валентных электронов металлов, отрываясь от атомов, становятся «свободными». «Свободные» электроны легко перемещаются между атомами и ионами металлов в кристалле, образуя «электронный газ» (рис. 28).
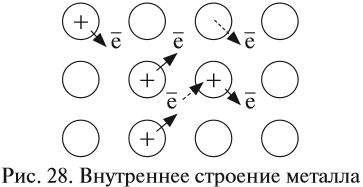
В последующий момент времени любой из «свободных» электронов может притянуться любым катионом, а любой атом металла может отдать электрон и превратиться в ион (эти процессы показаны на рис. 28 пунктирами).
Таким образом, внутреннее строение металла похоже на слоёный пирог, где положительно заряженные «слои» атомов и ионов металла чередуются с электронными «прослойками» и притягиваются к ним. Наилучшей моделью внутреннего строения металла является стопка стеклянных пластинок, смоченных водой: оторвать одну пластинку от другой очень трудно (металлы прочные), а сдвинуть одну пластинку относительно другой очень легко (металлы пластичные) (рис. 29).
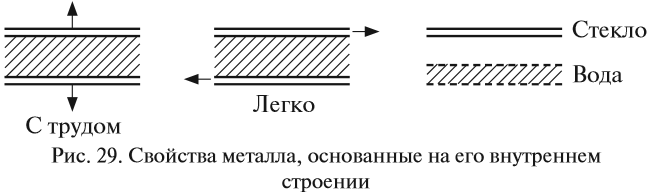
Задание 8.3. Сделайте такую «модель» металла и убедитесь в этих свойствах.
Химическая связь, осуществляемая за счёт «свободных» электронов, называется металлической связью.
«Свободные» электроны обеспечивают также такие физические свойства металлов, как электро- и теплопроводность, пластичность (ковкость), а также металлический блеск.
Задание 8.4. Найдите дома металлические предметы.
Выполняя это задание, вы легко найдёте на кухне металлическую посуду: кастрюли, сковородки, вилки, ложки. Из металлов и их сплавов делают станки, самолёты, автомобили, тепловозы, инструменты. Без металлов невозможна современная цивилизация, так как электрические провода также делают из металлов — Cu и Al. Только металлы годятся для получения антенн для радио- и телеприёмников, из металлов делают и лучшие зеркала. При этом чаще используют не чистые металлы, а их смеси (твёрдые растворы) — СПЛАВЫ.

Топ вопросов за вчера в категории Химия
Химия 20.06.2023 14:08 2126 Сапалов Андрей
№1. Определить валентность элементов в веществах. SiH4. CrO3. H2S. CO2. CO. SO3. SO2. Fe2O3. FeO.
Ответов: 1
Химия 01.07.2023 02:03 765 Шкребец Макс
Составьте формулу соединений железа (III) с серой
Ответов: 2
Химия 18.05.2023 16:56 868 Амангелды Моля
Определить валентность: FeS, Al2S3, SCl2, SCl4, CO, CO2, Na3P, Ca3P2
Ответов: 2
Химия 04.07.2023 04:40 698 Кривич Алексей
Вопрос Верны ли следующие суждения об условиях протекания реакций ионного обмена? А. Если в раство
Ответов: 2
Химия 23.09.2023 10:29 580 Бороденко Сергей
Задание 1 (60 баллов). Заполните таблицу для следующих явлений: сгибание медной проволоки; таяние
Ответов: 1
Химия 22.02.2021 12:23 324 Федів Антон
Рассчитайте массовые доли элементов в оксиде углерода (IV) – углекислом газе При выполнении задани
Ответов: 2
Химия 18.05.2023 12:20 237 Мерзлякова Света
Тест «Вода» 1.Какое свойство воды указано неверно: 1) прозрачна 3) бесцветна 2) не имеет запаха 4)
Ответов: 3
Химия 28.09.2023 06:32 106 Леонтьев Никита
Из предложенного перечня выберите две пары веществ, которые при комнатной температуре реагируют друг
Ответов: 2
Химия 03.10.2023 07:21 338 Романова Анна
Будут ли верны следующие утверждения при решении задачи расчёта соотношения масс железа и хлора в мо
Ответов: 2
Химия 01.07.2023 19:18 487 Романова Катя
Вопрос Массовая доля углерода одинакова в двух веществах, формулы которыхC2H4CH4C6H6C2H6C5H10
Ответов: 2
27.85. Химические свойства металлов
По своим химическим свойствам все металлы являются восстановителями, все они сравнительно легко отдают валентные электроны, переходят в положительно заряженные ионы, то есть окисляются. Восстановительную активность металла в химических реакциях, протекающих в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов, или ряду стандартных электродных потенциалов металлов.
Чем левее стоит металл в ряду стандартных электродных потенциалов, тем более сильным восстановителем он является, самый сильный восстановитель — металлический литий, золото — самый слабый, и, наоборот, ион золото (III) — самый сильный окислитель, литий (I) — самый слабый.
Каждый металл способен восстанавливать из солей в растворе те металлы, которые стоят в ряду напряжений после него, например, железо может вытеснять медь из растворов ее солей. Однако следует помнить, что металлы щелочных и щелочно‒земельных металлов будут взаимодействовать непосредственно с водой.
Металлы, стоящее в ряду напряжений левее водорода, способны вытеснять его из растворов разбавленных кислот, при этом растворяться в них.
Восстановительная активность металла не всегда соответствует его положению в периодической системе, потому что при определении места металла в ряду учитывается не только его способность отдавать электроны, но и энергия, которая затрачивается на разрушение кристаллической решетки металла, а также энергия, затрачиваемая на гидратацию ионов.
Физические свойства металлов:
1. Плотность металлов:
Легкие: Al, Na, Mg,Sn, Ga
Тяжелые: Cu, Pb, Fe, Hg, Cd
2. Температура плавления:
Легкоплавкие (t
Тугоплавкие (t>1000C): W, Cr, Fe, Mo, Nb
3. Твердость:
Мягкие: Na, Pb, Ba, In, Cd
Твердые: Cr, Fe, Zn, Ag
4. Общие свойства металлов: твердая кристаллическая структура, у большинства – серый цвет, металлический блеск, электро- и теплопроводность, ковкость и пластичность.
Способы получение металлов:
1. Пирометаллургия
Карботермия (при высоких температурах):
FeO + C = Fe + CO
Fe3O4 + 4C = 3Fe + 4CO2
Гидротермия (восстановление водородом)
WO3 + 3H2 = W + 3H2O
Fe2O3 + 3H2 = 2Fe + 3H2O
Вакуумтермия (восстановление более активными металлами)
KCl + Na = NaCl + K
TiCl4 + 2Mg = Ti + 2MgCl2
3BaO + 2Al = Al2O3 + 3Ba
2. Гидрометаллургия (как правило в несколько стадий)
1) CuO + H2SO4 = CuSO4 + H2O
2) CuSO4 + Fe = FeSO4 + Cu
3. Электрометаллургия – электролиз расплавов и растворов(подробнее эта тема рассматривается на уроке – электролиз)
Na[AlF4]
- 2Al2O3 = 4Al + 3O2
- 2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
- KCl = K + Cl2
- 4NaOH = 4Na + O2 + 2H2O
Химические свойства металлов:
|
Вещество |
Металл и условие реакции |
Пример |
|
С ПРОСТЫМИ ВЕЩЕСТВАМИ |
||
|
Галогены: F2, Cl2, Br2, I2 |
Большинство металлов |
Fe(Сr) + Г2 = 2FeГ3 НО: Fe(Cr) + I2 = FeI2 |
|
С кислородом |
Li, Ca, Al, Fe и другие |
4Li + O2 = 2Li2O 4Al+ 3O2 = 2Al2O3 3Fe + 2O2 = Fe3O4 |
|
Na, K |
2Na + O2 = Na2O2 (пероксид натрия) K + O2 = KO2 (супероксид калия) |
|
|
C серой образуются сульфида |
Металлы реагируют при нагревании |
2Na + S = Na2S Fe + S = FeS Cr + S = CrS 2Al + 3S = Al2S3 |
|
С азотом образуются нитриды |
Реагируют при нагревании |
6Li + N2 = 2Li3N 3Ca + N2 = Ca3N2 Fe + N2 = НЕ РЕАГИРУЕТ! 2Cr + N2 = 2CrN |
|
С фосфором образуются фосфиды |
При нагревании |
Na + P = Na3P Fe + P =FexPy (бертолиды) |
|
С углеродом образуются карбиды |
При нагревании |
2Li + 2C = Li2C2 Ca + 2C = CaC2 4Al + 3C = Al4C3 |
|
C кремнием образуются силициды |
При нагревании |
6Li + 2Si = Li6Si2 Mg + Si = Mg2Si |
|
C водородом образуются гидриды |
С кальцием при нагревании |
2Li + H2 = 2LiH Ca + H2 = CaH2 Al + H2 = НЕ РЕАГИРУЕТ! |
|
СО СЛОЖНЫМИ ВЕЩЕСТВАМИ |
||
|
С водой |
При нагревании, кроме Na, Ca, Sr, Ba, K, Li |
2Na + 2H2O = 2NaOH + H2 Mg + 2H2O = Mg(OH)2 + H2 3Fe + 4H2O = Fe3O4 + 4H2 |
|
В присутствии амальгамы |
2Al + 6H2O = 2Al(OH)3 + 3H2 |
|
|
С солями |
Вытесняют менее активный металл. Реакция не идет с металлами от Li до Na (в ряду активности метллов) |
Fe + CuSO4 = FeSO4 + Cu 2Mg + TiCl4 = 2MgCl2 + Ti |
|
Реакции с оксидами азота |
2Cu + NO2 = N2 + 2CuO Cu + N2O = N2 + CuO 2Cu + 2NO = N2 + 2CuO |
Сталь – сплав железа и углеродаНекоторые широко используемые сплавы:
Бронза – сплав меди с оловом
Латунь – сплав меди с цинком
Амальгамы – сплавы металлов, содержащие ртуть
Прочитано
Отметь, если полностью прочитал текст
Сравнительная характеристика свойств кислот
Сильные кислоты, такие как серная кислота и соляная кислота, обладают более высокой кислотностью и являются сильными окислителями. Они также могут вызывать ожоги и другие повреждения тканей при контакте с кожей или глазами.
Слабые кислоты, такие как уксусная кислота, могут использоваться в пищевой и медицинской промышленности. Они не вызывают серьезных повреждений при контакте с кожей или глазами.
Кислоты также могут быть классифицированы как минеральные или органические. Минеральные кислоты образуются в результате реакции металлов или неметаллов с кислородом, а органические кислоты содержат углерод в своей молекуле.
Ионы кислот также могут иметь различную зарядность. Например, серная кислота (H2SO4) имеет два отрицательных и один положительный ион, а фосфорная кислота (H3PO4) имеет три отрицательных и один положительный ион. Зарядность иона кислоты влияет на ее реакционную способность и взаимодействие с другими веществами.
Соли являются продуктом реакции кислоты и основания. Например, при реакции соляной кислоты (HCl) с гидроксидом натрия (NaOH) образуется соль натрия (NaCl) и вода (H2O):
HCl + NaOH → NaCl + H2O
Соли также могут быть классифицированы как кислые, основные или нейтральные, в зависимости от того, какая кислота и основание были использованы при их образовании. Например, сульфат меди (II) (CuSO4) является кислой солью, поскольку она образуется при реакции серной кислоты (H2SO4) и гидроксида меди (Cu(OH)2).
В заключение, кислоты – это важный класс химических соединений, имеющий широкое применение в различных областях, от производства удобрений и лекарств до производства пластмасс и красителей. Знание свойств и способов применения кислот является важным компонентом обучения химии и может быть полезным для решения практических задач в различных областях деятельности.
Ответы на вопрос
Отвечает Леонардыч Евгений.
Ответ:
Объяснение:
1. Закономерность в периодах:
Изменение некоторых характеристик элементов в периодах слева направо:
а) заряд ядер атомов увеличивается;
б) радиус атомов уменьшается;
в) электроотрицательность элементов увеличивается;
г) количество валентных электронов увеличивается от 1 до 8 (равно номеру группы);
д) высшая степень окисления увеличивается (равна номеру группы);
е) число электронных слоев атомов не изменяется;
ж) металлические свойства уменьшается;
з) неметаллические свойства элементов увеличивается.
2. Высшие оксиды элементов третьего периода:
от натрия к хлору постепенно основные свойста оксидов ослабевают и возрастают кислотные свойства.
Na₂O оксид натрия, щелочной оксид, при растворении в воде образует щелочь.
MgO оксид магния, щелочноземельный оксид, проявляет только основные свойства, малорастворим в воде,
AI₂O₃ оксид алюминия, амфотерный оксид, пооявляет основные и кислотные свойста.
SiO₂ оксид кремния, кислотный оксид, не растворим в воде.
P₂O₅ оксид фосфора(V), кислотный оксид, при растворении в воде образует слабую ортофосфорную кислоту H₃PO₄.
SO₃ оксид серы(IV), кислотный оксид, при растворении в воде образует сильную серную кислоту H₂SO₄ .
CI₂O₇ оксид хлора(VII), кислотный оксид, медленно растворяется в холодной воде, образуя сильную хлорную кислоту HCIO₄. Оксид хлора(VII) проявляет сильные окислительные свойства.
Элемент Аргон не образует соединение, он инертен другим элементам.
Отвечает Харьков Андрей.
Высшие оксиды химических элементов третьего периода включают атомы с номерами 11 (натрий) до 18 (аргон). Они образуют оксиды с более высокими степенями окисления в сравнении с основными оксидами, которые образуются при образовании основных соединений.
Следующие элементы третьего периода образуют высшие оксиды:
- Натрий (Na) образует пероксид (Na2O2) и супероксид (NaO2).
- Магний (Mg) образует пероксид (MgO2).
- Алюминий (Al) образует оксид (Al2O3).
- Кремний (Si) образует два основных оксида: оксид (SiO2) и диоксид (SiO4).
- Фосфор (P) образует оксид (P2O5).
- Сера (S) образует оксид (SO3).
- Хлор (Cl) образует оксид (Cl2O7).
- Аргон (Ar) образует оксид (ArO3).
Закономерности изменения свойств высших оксидов третьего периода связаны с положением элементов в периодической системе:
-
Оксиды натрия, магния и алюминия (Na2O2, NaO2, MgO2, Al2O3) являются сильными окислителями и обладают окислительными свойствами.
-
Оксиды кремния и фосфора (SiO2, SiO4, P2O5) обладают амфотерными свойствами, то есть они могут проявлять и кислотные, и основные свойства. Это связано с их способностью образовывать кислоты и основания при реакции с водой.
-
Оксид серы (SO3) является кислотным оксидом и может образовывать кислоты при реакции с водой.
-
Оксид хлора (Cl2O7) является кислотным оксидом и может образовывать кислоту при реакции с водой.
-
Оксид аргона (ArO3) является оксидом аргона и является нестабильным соединением, которое образуется только в лабораторных условиях.
Закономерности в изменении свойств высших оксидов в третьем периоде связаны с изменением электроотрицательности
Взаимодействие с кислородом
Многие металлы могут вступать в реакцию с кислородом. Обычно продуктами этих реакций являются оксиды, но есть и исключения, о которых вы узнаете на следующем уроке. Рассмотрим взаимодействие магния с кислородом.
Магний горит в кислороде, при этом образуется оксид магния:
2Mg + O2 = 2Mg+2O-2
Рис. 1. Горение магния в кислороде
Атомы магния отдают свои внешние электроны атомам кислорода: два атома магния отдают по два электрона двум атомам кислорода. При этом магний выступает в роли восстановителя, а кислород – в роли окислителя.
Видео-опыт: “Горение магния”
Обратите внимание!!! Серебро, золото и платина с кислородом не реагируют. 2
Взаимодействие с галогенами, образуются галогениды
2. Взаимодействие с галогенами, образуются галогениды
Для металлов характерна реакция с галогенами. Продуктом такой реакции является галогенид металла, например, хлорид.
Рис. 2. Горение калия в хлоре
Калий сгорает в хлоре образованием хлорида калия:
2К + Cl2 = 2K+1Cl-1
Два атома калия отдают молекуле хлора по одному электрону. Калий, повышая степень окисления, играет роль восстановителя, а хлор, понижая степень окисления,- роль окислителя
3. Взаимодействие с серой
Многие металлы реагируют с серой с образованием сульфидов. В этих реакциях металлы также выступают в роли восстановителей, тогда как сера будет окислителем. Сера в сульфидах находится в степени окисления -2, т.е. она понижает свою степень окисления с 0 до -2. Например, железо при нагревании реагирует с серой с образованием сульфида железа (II):
Fe + S = Fe+2S-2
Рис. 3. Взаимодействие железа с серой
Видео-опыт: “Взаимодействие цинка с серой”
Металлы также могут реагировать с водородом, азотом и другими неметаллами при определенных условиях.
4. Взаимодействие с водой
Металлы по — разному реагируют с водой:
Помните!!!
Алюминий реагирует с водой подобно активным металлам, образуя основание:
Видео-опыт: “Взаимодействие натрия с водой”
Раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe3O4 и водород: 3Fe+4H+12O−2 → Fe+2O−2⋅Fe+32O−23 + 4H2
5. Взаимодействие с кислотами
Металлы особо реагируют с серной концентрированной и азотной кислотами:
H2SO4 (конц.) + Me = соль + H2O + Х
|
Щелочные и щелочноземельные |
Fe, Cr, Al |
Металлы до водорода Сd-Pb |
Металлы после водорода (при t) |
Au, Pt |
|
|
X |
1)пассивируются на холоде; |
S↓ могут H2S илиSO2 |
— |
H2SO4 (разб) + Cu ≠
Внимание!
Pt, Au + H2SO4 (конц.) →реакции нет
Al, Fe, Cr + H2SO4 (конц.) холодная→ пассивация
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна






























