Растворимость веществ в воде
Растворимость – максимальная масса вещества, которая может раствориться в 100 г растворителя при определенной температуре. Вещества классифицируются на три группы в зависимости от степени растворимости.
- Хорошо растворимые – в 100 мл воды растворяется более 1 г вещества (сахар).
- Малорастворимые – в 100 мл воды растворяется 0,01-1 г вещества (гипс).
- Нерастворимые – в 100 мл воды растворяется менее 0,01 вещества (хлорид серебра (I)).
Большинство твердых веществ при нагревании растворяется быстрее. Растворимость газов повышается при понижении температуры и повышении давления.
Растворение многих веществ в воде сопровождается образованием оболочки из молекул воды. Данный комплекс называется гидратом. После кристаллизации в составе таких комплексов сохраняется часть молекул воды, образуя кристаллогидрат:
CuSO4 +5 H2O = CuSO4· 5H2O
«Эврика!» Открытие закона Архимеда
Однажды царь Сиракуз Гиерон II обратился к Архимеду с просьбой установить, действительно ли его корона выполнена из чистого золота, как утверждал ювелир. Правитель подозревал, что мастер прикарманил часть драгоценного металла и частично заменил его серебром.
В те времена не существовало способов определить химический состав металлического сплава. Задача поставила учёного в тупик. Размышляя над ней, он отправился в баню и лёг в ванну, до краёв наполненную водой. Когда часть воды вылилась наружу, на Архимеда снизошло озарение. Такое, что учёный голышом выскочил на улицу и закричал «Эврика!», что по-древнегречески означает «Нашёл!».

Он предположил, что вес вытесненной воды был равен весу его тела, и оказался прав. Явившись к царю, он попросил принести золотой слиток, равный по весу короне, и опустить оба предмета в наполненные до краёв резервуары с водой. Корона вытеснила больше воды, чем слиток. При одной и той же массе объём короны оказался больше, чем объём слитка, а значит, она обладала меньшей плотностью, чем золото. Выходит, царь правильно подозревал своего ювелира.
Так был открыт принцип, который теперь мы называем законом Архимеда:
На тело, погружённое в жидкость или газ, действует выталкивающая сила, равная весу жидкости или газа в объёме погружённой части тела.
Эта выталкивающая сила и называется силой Архимеда.
<<Форма демодоступа>>
Замерзание воды и водных растворов в различных условиях
Процессы замерзания воды и ее растворов отличаются многообразием. Например, в грунте при отрицательной температуре некоторая часть влаги все-таки сохраняется в жидком состоянии, хотя в природе чистая вода замерзает при 0оС. В работах Н.А.Цытовича продемонстрировано, что по мере нагревания (при фоновой отрицательной температуре) содержание жидкой воды в грунте увеличивается.
Существуют особенности в процессе замерзания воды, содержащей растворенные соли. Когда ее температура опускается до точки замерзания, первыми обнаруживаются ледяные кристаллы, которые выглядят как шестигранные призмы, похожие на иглы. Эти кристаллы содержат чистую воду, соли по-прежнему находятся в растворе, их концентрация при этом увеличивается. В связи с тем, что лед легче воды, ледяные иглы поднимаются на поверхность, делая внешний вид водоема похожим на пятна жира.
Определить точную температуру кристаллизации льда легко для бесконечно разбавленных смесей. В случае же концентрированных растворов, протекающие процессы более сложные, поэтому численные результаты требуют дополнительной обработки.
При таянии морского льда вначале вытаивает соль, т. е. остается в жидком растворе. По этой причине полярный лед превращается в пресную субстанцию.
В районе морского берега лед образовывается раньше, чем на глубине. «Прилипая» к береговой линии, он формирует припай, который при тихой погоде может занять территорию до нескольких десятков километров. Сильные ветры могут отрывать части припая и уносить на глубину.
Особенности замерзания морской воды проявляются также в зависимости температуры замерзания от ее химического состава. Известно, что в различных морях различное количество солей. Так, в озере Сиваш она имеет соленость 100 промилле, а в Кара-Богаз-Голе — 250 промилле. Температуры замерзания этих вод соответственно -6 оС и -10 оС.
Существует специальная таблица, по которой можно определить, при каких значениях температуры воздуха произойдет замерзание воды, содержащей примеси:
| Соленость в °/00 | Температура замерзания (в градусах) | Соленость в °/00 | Температура замерзания (в градусах) |
| 0 (пресная вода) | 20 | -1,1 | |
| 2 | -0,1 | 22 | -1,2 |
| 4 | -0,2 | 24 | -1,3 |
| 6 | -0,3 | 26 | -1,4 |
| 8 | -0,4 | 28 | -1,5 |
| 10 | -0,5 | 30 | -1,6 |
| 12 | -0,6 | 32 | -1,7 |
| 14 | -0,8 | 35 | -1,9 |
| 16 | -0,9 | 37 | -2,0 |
| 18 | -1,0 | 39 | -2,1 |
Согласно таблице при увеличении солености на каждые 2 промилле, температура замерзания воды понижается на 0,1 оС. Так, для замерзания воды в океане (соленость 35 промилле) необходима температура около -2оС.
Анализируя таблицу, можно сделать вывод, что соленость Азовского моря, равная 12 промилле, обеспечивает снижение температуры его замерзания до -0,6 оС. А воды Белого моря (его открытой части), имея соленость 25 промилле, замерзнут при температуре -1,4 оС.
Зависимость от температуры
Все измерения нужно проводить при стандартной комнатной температуре, потому что в горячем и холодном состоянии значения будут другими, не равными, а различными, Если возникла потребность в проведении нестандартных определений, нужно измерить температуру, затем плотность и по таблице получить показания, соответствующие нормальным условиям.
Плотность воды находится в заметной зависимости от температуры, например разница между значениями, измеренными при 18 и при 20 ℃, составляет 0,4 кг/м3.
При охлаждении плотность немного понижается, и при нагревании также происходит ее постепенное понижение. В этом вода отличается от всех других веществ, которые при охлаждении становятся плотнее.
Феномен объясняется способностью полярных водных молекул образовывать конгломераты, которые иногда называют ассоциатами или кластерами. В зависимости от величины этих образований, их пространственной формы, наличия воздушных полостей между группами масса стандартной единицы объема имеет разные значения.
В агрегатном состоянии пара все молекулы находятся на большом расстоянии друг от друга, притягиваться не могут, поэтому значения плотности маленькие. Уменьшение плотности при нагревании происходит постепенно, например при 60 ℃ показатель равен 983,2 кг/м3, а при 100 °С – 958,4 кг/м3.
При замерзании, еще до образования льда, кластеры приобретают форму, содержащую большое количество воздушных полостей, что объясняет также понижение значения плотности. Кстати, по этой причине лед плавает на поверхности северных морей и океанов. Если бы он имел большую плотность, айсберги постепенно оседали бы в виде ледяных пластов на дно, заполняя акваторию по всей глубине, не оставляя шансов на выживание морским рыбам и млекопитающим этих климатических зон.
Зависимость плавучести от плотности тела
Итак, мы выяснили, что в зависимости от того будет ли выталкивающая сила больше или меньше веса тела, является свойство его плавучести.
Если выталкивающая сила больше — тело плавает, если меньше — тонет.
Прямой связью того, будет ли тело плавать, является отношением плотности среды к плотности тела, погружаемого в эту самую среду (жидкую или газовую). Вспоминаем курс физики, — плотность тела есть отношение его массы к объему. В наших экспериментах были использовались такие вещества с соответствующими плотностями: бетон — 3000 кг/м3, дерево — 500 кг/м3 и вода 1000 кг/и3. А как же корабли, которые в большей своей массе сделаны из металлов, плотность которых существенно превышает плотность воды?
Здесь стоит помнить, что металлическая часть кораблей это лишь его каркас с элементами усиления, а внутри все остается полым (воздухом).
И в результате в расчетную часть плотности входит этот самый объем воздуха полой части. В итоге результирующая часть выталкивающей силы больше веса тела.
Ареометр — прибор для измерения плотности жидкости. Чем больше плотность жидкости, тем больше выталкивающая сила, и тем выше всплывает корпус прибора.

Все вышеописанное касается не только жидких сред, но и газовых. Возьмем всеми любимые воздушные шары. Они тоже плавают, но только в воздухе. Воздух нагретый горелкой внутри шара имеет меньшую плотность, чем окружающий воздух меньшей температуры. В результате воздушный шар отрывается от земли. Что жа на счет волшебства моментально взлетающих шаров, наполненных газом под названием гелий? Здесь опять же все дело в разности плотности газов гелия и воздуха. Плотность гелия меньше воздуха, поэтому лини с легкостью взлетают на праздничные мероприятия в воздух.
Температура солёной воды
Плотность солёной воды, при температуре 20 градусов и солёности 35 промилле, равна 10248 кг/м3.
Температура солёной воды является одним из важных параметров, которые влияют на её свойства. Условия солёности и температуры могут существенно изменяться в различных регионах океана и морей.
Плотность солёной воды зависит от её солёности и температуры. При повышении солёности увеличивается плотность воды, а при понижении солёности плотность уменьшается. Температура также влияет на плотность — при повышении температуры плотность солёной воды уменьшается, а при понижении — увеличивается.
Измерение плотности солёной воды является важной задачей при исследовании океанологических процессов, таких как циркуляция и перемешивание водных масс. Знание плотности солёной воды позволяет проводить более точные расчеты и моделирование гидродинамических процессов
Плотность солёной воды при различных температурах Температура (градусы) Плотность (кг/м3)
999.87 5 1000.05 10 999.70 15 999.10 20 998.21 25 997.04 30 995.65 35 994.03 40 992.25
Из таблицы видно, что плотность солёной воды уменьшается при повышении температуры. Такая зависимость обусловлена изменением плотности молекул воды при изменении температуры и взаимодействием солей с водой.
Изучение температуры солёной воды является важным аспектом при изучении климатических изменений, а также при проведении исследований по влиянию солёности и температуры на океанские и морские экосистемы.
Влияние температуры на плотность
Температура воды имеет существенное влияние на ее плотность.
При повышении температуры, плотность соленой воды снижается.
При температуре 20 градусов и солености 35 промилле, плотность воды равна 10248 кг/м3.
При повышении температуры, межмолекулярные взаимодействия водных молекул ослабевают,
что приводит к увеличению среднего расстояния между молекулами.
Это, в свою очередь, приводит к снижению плотности воды.
Таким образом, с увеличением температуры соленой воды, ее плотность уменьшается.
Это является важным фактором при изучении морской гидрологии и атмосферных явлений.
Расчет плотности при температуре 20 градусов
При температуре 20 градусов вода имеет плотность, равную 10248 кг/м3. Это значение было получено при солёности 35 промилле.
Плотность воды зависит от температуры и солёности. При увеличении температуры плотность уменьшается, а при увеличении солёности — увеличивается.
Расчет плотности воды осуществляется по формуле:
- Установить значения температуры и солёности.
- Взять соответствующие значения из таблицы зависимости плотности от температуры и солёности.
- Используя найденные значения, вычислить плотность воды.
Расчет плотности при других значениях температуры и солёности поможет определить, как эти параметры влияют на плотность воды.
Факт 4: Влияние плотности воды на рыбу и морские организмы
Плотность воды имеет огромное значение для жизни рыб и других морских организмов. Вода различных природных водоемов имеет разную плотность из-за наличия в ней разных солей и минералов.
Плотность воды может оказывать влияние на жизнеспособность морских организмов. Если плотность воды слишком низкая, рыбы и другие живые существа могут испытывать трудности с плаванием и поддержанием равновесия в воде. Они могут чувствовать себя более легкими и иметь проблемы с перетравливанием пищи.
С другой стороны, очень высокая плотность воды также может быть неблагоприятной для жизни морских организмов. Из-за большого давления они могут испытывать затруднения с дыханием и получением пищи, а также страдать от проблем с гидростатикой.
Плотность воды может варьироваться в разных морских бассейнах и областях океана в зависимости от солености, температуры и глубины. Рыбы и морские организмы адаптируются к этим условиям и развивают специальные анатомические и физиологические адаптации для выживания в конкретном морском окружении.
Некоторым видам рыб и морских организмов, таким как лосось и акула, удается перемещаться между водными средами с разной плотностью. Они могут подниматься к верхним слоям океана с низкой плотностью для поиска пищи и возвращаться в глубокие воды с высокой плотностью для отдыха и размножения.
Исследование влияния плотности воды на рыб и морские организмы является важной областью науки и помогает нам понять, какие условия наиболее благоприятны для их выживания и какие меры защиты следует принимать для сохранения их популяций и экосистем морей и океанов
Распределение плотности на Поверхности и по глубинам в Мировом океане
§ 34. Распределение плотности на Поверхности и по глубинам в Мировом океане
Характерной особенностью распределения плотности на поверхности Мирового океана служит увеличение ее от экватора к полюсам в пределах 1,0220—1,0275 до 60° северной и южной широты. В некоторых районах экваториальной зоны плотность понижается до 1,0210—1,02005 и менее, как, например, в Бенгальском заливе, в морях Зондского архипелага, что связано с высокой температурой и относительно пониженной соленостью. В пассатных областях. плотность заметно возрастает и далее постепенно увеличивается в направлении к полюсам. Максимальные значения плотности наблюдаются в Антарктике у кромки льда (1,0275), севернее Исландии и к юго-западу от Шпицбергена (1,0280). В Морском атласе приводится распределение плотности морской воды на поверхности Мирового океана. Если эту схему сравнить с картой изотерм и изогалин, то большее соответствие обнаруживается с картами распределения температуры, что свидетельствует о большем влиянии последней на плотность поверхностных вод. Неравномерное распределение температуры, а следовательно, и плотности на поверхности Мирового океана приводит к опусканию плотных полярных вод и движению их в направлении к экватору в глубинных слоях, а легких тропических — по поверхности к полюсам. Вследствие этой плотностной циркуляции формируются глубинные холодные придонные воды Мирового океана практически с постоянной температурой 0-2° С и соленостью 34,80—34,60‰
Вертикальное перемешивание слоев
С глубиной плотность изменяется в связи с изменением температуры, солености и давления. При понижении температуры и увеличении солености плотность увеличивается. Однако нормальная стратификация плотности нарушается в отдельных районах Мирового океана в связи с региональными, сезонными и другими изменениями температуры и солености. В экваториальной зоне, где поверхностные воды относительно опреснены и имеют температуру 25-28° С, они подстилаются более солеными холодными водами, поэтому плотность резко возрастает до горизонта 200 м, а затем медленно увеличивается к 1500 м, после чего становится почти постоянной. В умеренных широтах, где в предзимнее время происходит охлаждение поверхностных вод, плотность увеличивается, развиваются конвективные токи и более плотная вода опускается, а менее плотная поднимается к поверхности — возникает вертикальное перемешивание слоев.
Источник
Плотность воды в зависимости от температуры
Принято считать, что плотность воды равна 1000 кг/м3, 1000 г/л или 1 г/мл, но часто ли мы задумываемся при какой температуре получены эти данные?
Максимальная плотность воды достигается при температуре 3,8…4,2°С. В этих условиях точное значение плотности воды составляет 999,972 кг/м3. Такая температурная зависимость плотности характерна только для воды. Другие распространенные жидкости не имеют максимума плотности на этой кривой — их плотность равномерно снижается по мере роста температуры.
Вода существует как отдельная жидкость в диапазоне температуры от 0 до максимальной 374,12°С — это ее критическая температура, при которой исчезает граница раздела между жидкостью и водяным паром. Значения плотность воды при этих температурах можно узнать в таблице ниже. Данные о плотности воды представлены в размерности кг/м3 и г/мл.
В таблице приведены значения плотности воды в кг/м3 и в г/мл (г/см3), допускается интерполяция данных. Например, плотность воды при температуре 25°С можно определить, как среднее значение от величин ее плотности при 24 и 26°С. Таким образом, при температуре 25°С вода имеет плотность 997,1 кг/м3 или 0,9971 г/мл.
Значения в таблице относятся к пресной или дистиллированной воде. Если рассматривать, например, морскую или соленую воду, то ее плотность будет выше — плотность морской воды равна 1030 кг/м3. Плотность соленой воды и водных растворов солей можно узнать в этой таблице.
| t, °С | ρ, кг/м3 | ρ, г/мл | t, °С | ρ, кг/м3 | ρ, г/мл | t, °С | ρ, кг/м3 | ρ, г/мл |
|---|---|---|---|---|---|---|---|---|
| 999,8 | 0,9998 | 62 | 982,1 | 0,9821 | 200 | 864,7 | 0,8647 | |
| 0,1 | 999,8 | 0,9998 | 64 | 981,1 | 0,9811 | 210 | 852,8 | 0,8528 |
| 2 | 999,9 | 0,9999 | 66 | 980 | 0,98 | 220 | 840,3 | 0,8403 |
| 4 | 1000 | 1 | 68 | 978,9 | 0,9789 | 230 | 827,3 | 0,8273 |
| 6 | 999,9 | 0,9999 | 70 | 977,8 | 0,9778 | 240 | 813,6 | 0,8136 |
| 8 | 999,9 | 0,9999 | 72 | 976,6 | 0,9766 | 250 | 799,2 | 0,7992 |
| 10 | 999,7 | 0,9997 | 74 | 975,4 | 0,9754 | 260 | 783,9 | 0,7839 |
| 12 | 999,5 | 0,9995 | 76 | 974,2 | 0,9742 | 270 | 767,8 | 0,7678 |
| 14 | 999,2 | 0,9992 | 78 | 973 | 0,973 | 280 | 750,5 | 0,7505 |
| 16 | 999 | 0,999 | 80 | 971,8 | 0,9718 | 290 | 732,1 | 0,7321 |
| 18 | 998,6 | 0,9986 | 82 | 970,5 | 0,9705 | 300 | 712,2 | 0,7122 |
| 20 | 998,2 | 0,9982 | 84 | 969,3 | 0,9693 | 305 | 701,7 | 0,7017 |
| 22 | 997,8 | 0,9978 | 86 | 967,8 | 0,9678 | 310 | 690,6 | 0,6906 |
| 24 | 997,3 | 0,9973 | 88 | 966,6 | 0,9666 | 315 | 679,1 | 0,6791 |
| 26 | 996,8 | 0,9968 | 90 | 965,3 | 0,9653 | 320 | 666,9 | 0,6669 |
| 28 | 996,2 | 0,9962 | 92 | 963,9 | 0,9639 | 325 | 654,1 | 0,6541 |
| 30 | 995,7 | 0,9957 | 94 | 962,6 | 0,9626 | 330 | 640,5 | 0,6405 |
| 32 | 995 | 0,995 | 96 | 961,2 | 0,9612 | 335 | 625,9 | 0,6259 |
| 34 | 994,4 | 0,9944 | 98 | 959,8 | 0,9598 | 340 | 610,1 | 0,6101 |
| 36 | 993,7 | 0,9937 | 100 | 958,4 | 0,9584 | 345 | 593,2 | 0,5932 |
| 38 | 993 | 0,993 | 105 | 954,5 | 0,9545 | 350 | 574,5 | 0,5745 |
| 40 | 992,2 | 0,9922 | 110 | 950,7 | 0,9507 | 355 | 553,3 | 0,5533 |
| 42 | 991,4 | 0,9914 | 115 | 946,8 | 0,9468 | 360 | 528,3 | 0,5283 |
| 44 | 990,6 | 0,9906 | 120 | 942,9 | 0,9429 | 362 | 516,6 | 0,5166 |
| 46 | 989,8 | 0,9898 | 125 | 938,8 | 0,9388 | 364 | 503,5 | 0,5035 |
| 48 | 988,9 | 0,9889 | 130 | 934,6 | 0,9346 | 366 | 488,5 | 0,4885 |
| 50 | 988 | 0,988 | 140 | 925,8 | 0,9258 | 368 | 470,6 | 0,4706 |
| 52 | 987,1 | 0,9871 | 150 | 916,8 | 0,9168 | 370 | 448,4 | 0,4484 |
| 54 | 986,2 | 0,9862 | 160 | 907,3 | 0,9073 | 371 | 435,2 | 0,4352 |
| 56 | 985,2 | 0,9852 | 170 | 897,3 | 0,8973 | 372 | 418,1 | 0,4181 |
| 58 | 984,2 | 0,9842 | 180 | 886,9 | 0,8869 | 373 | 396,2 | 0,3962 |
| 60 | 983,2 | 0,9832 | 190 | 876 | 0,876 | 374,12 | 317,8 | 0,3178 |
Следует отметить, что при увеличении температуры воды (выше 4°С) ее плотность уменьшается. Например, по данным таблицы, плотность воды при температуре 20°С равна 998,2 кг/м3, а при ее нагревании до 90°С, величина плотности снижается до значения 965,3 кг/м3. Удельная масса воды при нормальных условиях значительно отличается от ее плотности при высоких температурах. Средняя плотность воды, находящейся при температуре 200…370°С намного меньше ее плотности в обычном температурном диапазоне от 0 до 100°С.
Смена агрегатного состояния воды приводит к существенному изменению ее плотности. Так, величина плотности льда при 0°С имеет значение 916…920 кг/м3, а плотность водяного пара составляет величину в сотые доли килограмма на кубический метр. Следует отметить, что значение плотности воды почти в 1000 раз больше плотности воздуха при нормальных условиях.
Кроме того, вы также можете ознакомиться с таблицей плотности веществ и материалов.
Физические свойства воды при температуре от 0 до 100°С
В таблице представлены следующие физические свойства воды: плотность воды ρ, удельная энтальпия h, удельная теплоемкость Cp, теплопроводность воды λ, температуропроводность воды а, вязкость динамическая μ, вязкость кинематическая ν, коэффициент объемного теплового расширения β, коэффициент поверхностного натяжения σ, число Прандтля Pr. Физические свойства воды приведены в таблице при нормальном атмосферном давлении в интервале от 0 до 100°С.
Физические свойства воды существенно зависят от ее температуры. Наиболее сильно эта зависимость выражена у таких свойств, как удельная энтальпия и динамическая вязкость. При нагревании значение энтальпии воды значительно увеличивается, а вязкость существенно снижается. Другие физические свойства воды, например, коэффициент поверхностного натяжения, число Прандтля и плотность уменьшаются при росте ее температуры. К примеру, плотность воды при нормальных условиях (20°С) имеет значение 998,2 кг/м3, а при температуре кипения снижается до 958,4 кг/м3.
Такое свойство воды, как теплопроводность (или правильнее — коэффициент теплопроводности) при нагревании имеет тенденцию к увеличению. Теплопроводность воды при температуре кипения 100°С достигает значения 0,683 Вт/(м·град). Температуропроводность H2O также увеличивается при росте ее температуры.
Следует отметить нелинейное поведение кривой зависимости удельной теплоемкости этой жидкости от температуры. Ее значение снижается в интервале от 0 до 40°С, затем происходит постепенный рост теплоемкости до величины 4220 Дж/(кг·град) при 100°С.
| t, °С → | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| ρ, кг/м3 | 999,8 | 999,7 | 998,2 | 995,7 | 992,2 | 988 | 983,2 | 977,8 | 971,8 | 965,3 | 958,4 |
| h, кДж/кг | 42,04 | 83,91 | 125,7 | 167,5 | 209,3 | 251,1 | 293 | 335 | 377 | 419,1 | |
| Cp, Дж/(кг·град) | 4217 | 4191 | 4183 | 4174 | 4174 | 4181 | 4182 | 4187 | 4195 | 4208 | 4220 |
| λ, Вт/(м·град) | 0,569 | 0,574 | 0,599 | 0,618 | 0,635 | 0,648 | 0,659 | 0,668 | 0,674 | 0,68 | 0,683 |
| a·108, м2/с | 13,2 | 13,7 | 14,3 | 14,9 | 15,3 | 15,7 | 16 | 16,3 | 16,6 | 16,8 | 16,9 |
| μ·106, Па·с | 1788 | 1306 | 1004 | 801,5 | 653,3 | 549,4 | 469,9 | 406,1 | 355,1 | 314,9 | 282,5 |
| ν·106, м2/с | 1,789 | 1,306 | 1,006 | 0,805 | 0,659 | 0,556 | 0,478 | 0,415 | 0,365 | 0,326 | 0,295 |
| β·104, град-1 | -0,63 | 0,7 | 1,82 | 3,21 | 3,87 | 4,49 | 5,11 | 5,7 | 6,32 | 6,95 | 7,52 |
| σ·104, Н/м | 756,4 | 741,6 | 726,9 | 712,2 | 696,5 | 676,9 | 662,2 | 643,5 | 625,9 | 607,2 | 588,6 |
| Pr | 13,5 | 9,52 | 7,02 | 5,42 | 4,31 | 3,54 | 2,93 | 2,55 | 2,21 | 1,95 | 1,75 |
Примечание: Температуропроводность в таблице дана в степени 108 , вязкость в степени 106 и т. д. для других свойств. Размерность физических свойств воды выражена в единицах СИ.
Растворенный в воде кислород
— поверхностная — слой ветрового перемешивания, в котором содержание кислорода стремится к 100% насыщению;
— слой подповерхностного кислородного максимума (10-50 м) со степенью насыщения 120-140 %, образующийся на верхней границе слоя скачка;
— холодный промежуточный слой (ХПС), характеризующийся наличием отрицательных температур в течение всего года (20- 200 м) и степенью насыщения 80-90%;
— слой промежуточных вод (150-750 м), характеризующийся уменьшением кислорода до 15-20% насыщения;
— слой минимальных концентраций кислорода (750-1500 м), со степенью насыщения 10-15%;
— глубинные воды Южной котловины, где степень насыщения возрастает до 28%, а концентрация его составляет 2,0-3,0 мг/л.
Сезонные изменения растворенного в воде кислорода по многолетним данным прослеживаются до глубин 400-500 м. В свою очередь появление слоя скачка препятствует поступлению биогенных веществ из глубины за счет конвекции, что приводит к истощению их в поверхностном слое и затуханию активной фотосинтетической деятельности, а отток кислорода в атмосферу с поверхностных горизонтов по мере их прогрева и обусловливает появление подповерхностного максимума на кривой его вертикального распределения.
Однако для шельфовой зоны Охотского моря такое распределение не является характерным вследствие активного перемешивания вод на мелководье и проникновения в поверхностные слои придонных вод с большим дефицитом кислорода, в результате чего пространственно-временное распределение кислорода, равно как и других гидрохимических показателей, в шельфовых водах имеет явно выраженный пятнистый характер, обусловленное чередованием зон подъема и опускания вод.
Отличительной особенностью годового хода растворенного в воде кислорода в верхнем 100-метровом слое на охотоморском шельфе являются более высокие, по сравнению с Татарским проливом, абсолютные величины средних концентраций весной и летом, при равенстве их осенью ().
Подповерхностный максимум кислорода начинает формироваться весной преимущественно в пришельфовой глубоководной области сначала в проливе Лаперуза, а затем, по мере отступления кромки льда и прогрева вод, это явление (как и вспышки фитопланктона) постепенно распространяется к северу. Весной он располагается в поверхностном слое до 20 м, летом заглубляется до 30 м, а к осени нижняя граница слоя однородного содержания кислорода достигает глубины 50 м, после чего концентрация его начинает резко падать до величины 3,3-3,5 мл/л на глубине 500 м.
Особенностью пространственного распределения на поверхности весной и летом является уменьшение концентрации кислорода с севера на юг, что обусловлено снижением его растворимости при повышении температуры воды (рис. 4). Осенью на всех исследуемых акваториях содержание кислорода выравнивается и находится в пределах 6,6-6,7 мл/л. В подповерхностных горизонтах во все сезоны по пониженному содержанию кислорода хорошо прослеживаются субтропические воды течения Соя в проливе Лаперуза, а на северо-восточном шельфе распресненные воды реки Амур.
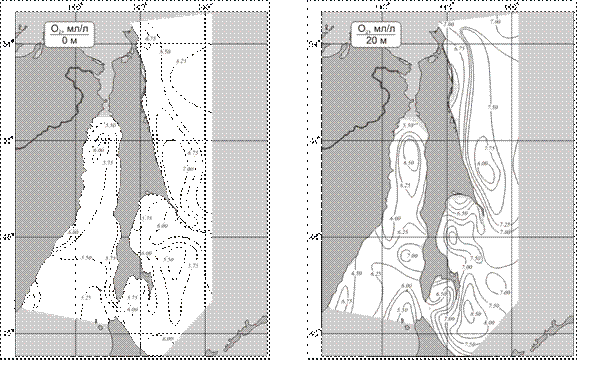
Рисунок 4 – Распределение средних многолетних значений солености воды на поверхности и горизонте 20 м. Лето
В вертикальном распределении средних значений кислорода для весны и лета характерно наличие подповерхностного максимума на глубинах 20-50 м (рис. 5), в то время как для осени отличительной чертой является практически полная гомогенность в распределении кислорода в верхнем 100-метровом слое. Летний минимум кислорода во всей шельфовой зоне прослеживается до глубин 20-25 м. 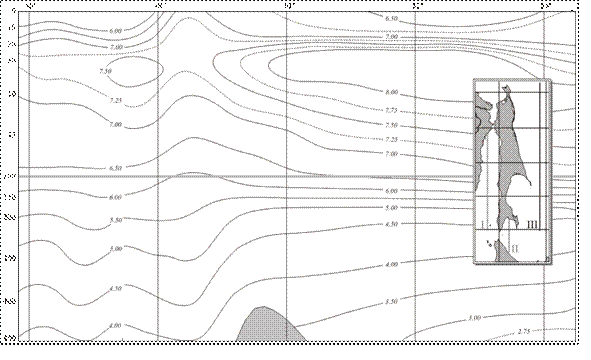
Рисунок 5 – Распределение средних многолетних значений растворенного кислорода (мл/л) на разрезе III. Лето




























