Определение изобарной теплоемкости воздуха
цель работы
Усвоение
и закрепление теоретического материала
по разделу технической термодинамики
“Теплоемкость газов”, а также
овладение одним из способов
экспериментального определения
теплоемкости воздуха.
Задание
-
Изучить схему
экспериментальной установки, включить
ее и вывести на заданный стационарный
режим. -
Провести
опыт в соответствии с методическими
указаниями, заполнить таблицу измерений. -
Определить
массовую изобарную среднюю теплоемкость
воздуха. -
Найти
справочное значение массовой изобарной
средней теплоемкости воздуха на заданном
интервале температур. -
Вычислить
погрешность найденного значения
массовой изобарной средней теплоемкости
по отношению к табличному. -
Сделать
выводы по работе.
Методические указания
Удельной
теплоемкостью называется количество
тепла, которое необходимо подвести к
единице количества вещества ( 1 кг , 1
моль , 1 м3 ), чтобы изменить его температуру на 1
градус. В связи с этим различают массовую
с, кДж/(кг·град), мольную μc, кДж/(кмоль·град)
и объемную с’, кДж/(м3·град)
теплоемкости, которые связаны
соотношениями:
;
(1)
,
где
μ – молекулярная масса вещества,
кг/моль;
ρн – плотность вещества при нормальных
условиях ( t = 0 ˚С, p = 760 мм.рт.ст), кг/м3.
(2)
Теплоемкость
при x = V = const называется изохорной
(Cv),
а при x = p = const – изобарной (Cp).
Эти теплоемкости для идеальных газов
связаны соотношением:
Cp –Cv = R ,
(3)
называемым
уравнением Майера.
Определяемая
выражением (2) теплоемкость при данной
температуре называется истинной.
Если
в процессе нагрева (охлаждения) при
постоянном давлении участвует М кг
газа, средняя массовая изобарная
теплоемкость (Дж/(кг · град)) определяется
по формуле
,
где
Q – количество теплоты, Дж;
(
t2 –
t1 ) – интервал температур, °С.
Данная формула
положена в основу экспериментального
определения изобарной теплоемкости
воздуха.
Экспериментальная установка
2
5
1
Рисунок.
Схема экспериментальной установки
Экспериментальная
установка (рисунок) состоит из
калориметрической стеклянной трубки
3, снабженной электронагревателем 4 и
наружной теплоизолирующей оболочкой
5. Воздух вентилятором 10 продувается
через калориметрическую стеклянную
трубку 3. Расход воздуха регулируется
автотрансформатором 9 и измеряется
ротаметром 11. Мощность нагревателя
регулируется автотрансформатором 8 и
определяется по показателям амперметра
6 и вольтметра 7. Температура воздуха на
входе и выходе из трубки измеряется
термометрами 1 и 2, а абсолютное давление
определяется по показаниям U-образного
водяного манометра 12 и барометра 13.
Б) Влияние рода газа на его теплоемкость Из молекулярно-кинетической теории идеального газа известно, что
где
– число поступательных и вращательных
степеней свободы движения молекул
данного газа. Тогда
,
а
.
(1.7)
Одноатомный газ
имеет три поступательных степени свободы
движения молекулы (рис.1.3а
),
т.е.
.
Двухатомный газ
имеет три поступательных степени свободы
движения и две степени свободы
вращательного движения молекулы (рис.
1.3б
),
т.е.
.
Аналогично можно показать, что для
трехатомного газа.
Таким образом,
мольная теплоемкость газов зависит от
числа степеней свободы движения молекул,
т.е. от числа атомов в молекуле
,
а удельная теплоемкость зависит также
от молекулярной массы,
т.к. от неё зависит значение газовой
постоянной,
которая различна для разных газов.
СМЕСИ И СМЕШИВАНИЕ ГАЗОВ
В качестве рабочего тела во многих случаях используют не чистые газы, а их механические смеси, такие, как воздух, продукты сгорания и др. В таких смесях химические реакции между составляющими смесь газами отсутствуют, а каждый газ ведет себя так, как будто он один занимает весь объем сосуда: молекулы его рассеиваются равномерно в пространстве и создают свое, называемое парциальным, давление /?, на стенки сосуда. Если смесь находится в равновесном состоянии, температура всех газов одинакова и равна температуре смеси Тсм. Масса смеси равна сумме масс компонентов; давление смеси по закону Дальтона равно сумме парциальных давлений:
где п — число компонент, составляющих смесь.
Свойства смеси зависят от ее состава, который можно задавать различными способами. Наиболее простой и удобный — задание массового состава, т.е. для каждого газа задается его массовая доля в смеси:
Мольной долей называют отношение числа киломолей данного газа к числу киломолей всей смеси:
где , ц, — молекулярная масса /’-й компоненты.
Величину называют кажущейся молекуляр
ной массой смеси. Часто состав смеси задают объемными долями
, где Vi — парциальный объем /’-й компоненты, т. е. такой объем, который занимал бы данный газ, если бы его давление было не Pj, а рсм (при той же температуре
Для действительного состояния связь между параметрами определяется уравнением р,Усм = /яДГсм, а для условного — ршУ( — mДТСМ. Из равенства правых частей этих уравнений следует р,Усм — pCMVj, откуда находим две важные формулы:
Важно знать соотношения между величинами gp у, и гг Чтобы найти эти соотношения, проведем следующие простые преобразования, не требующие дополнительных пояснений:
Здесь 22,4 — объем 1 кмоля любого газа при нормальных условиях, м 3 (по закону Авогадро именно таким объемом обладает большинство газов, хотя бывают и небольшие отклонения). Объемная доля
Поскольку правые части полученных формул одинаковы, можно сделать заключение, что мольные доли равны объемным: у, = г,. Еще одно соотношение получим так:
Заменив у, на /*, запишем его по-другому: г, ц, = gt цсм и просуммируем полученные формулы для всех п компонент смеси. В результате будем иметь
На основании свойства аддитивности для расчета теплоемкостей смеси можно записать следующие формулы:
Величину газовой постоянной находят аналогично:
или же, как и для любого газа, через универсальную газовую постоянную по формуле RCM = 831 4/jlicm.
В) Влияние параметров состояния газа на его теплоемкость
Теплоемкость
идеального газа зависит только от
температуры и увеличивается при
увеличении Т
.
Одноатомные газы
представляют исключение, т.к. их
теплоемкость практически не зависит
от температуры.
Классическая
молекулярно-кинетическая теория газов
позволяет довольно точно определить
теплоемкости одноатомных идеальных
газов в широком диапазоне температур
и теплоемкости многих двухатомных (и
даже трехатомных) газов при невысоких
температурах.
Но при температурах,
существенно отличных от 0 о С,
экспериментальные значения теплоемкости
двух- и многоатомных газов оказываются
значительно отличающимися от предсказанных
молекулярно-кинетической теорией.
с
v
Т
В теплотехнических
расчетах обычно пользуются опытными
значениями теплоемкости газов,
представленными в виде таблиц. При этом
теплоемкость, определенная в опыте (при
данной температуре), называется истинной
теплоемкостью. А если в опыте измерялось
количество теплоты q
,
которое было затрачено на существенное
повышение температуры 1 кг газа от
некоторой температуры T
0
до
температуры
T
,
т.е. на Т
= Т
T
0
, то отношение
называется средней
теплоемкостью газа в данном интервале
температур.
Обычно в справочных
таблицах значения средней теплоемкости
даются при значении T
0
, соответствующем
нулю градусов Цельсия.
Теплоемкость
реального
газа
зависит, кроме температуры, также и от
давления из-за влияния сил межмолекулярного
взаимодействия.
Учитывая, что теплоемкость непостоянна,
а зависит от температуры и других
термических параметров, различают
истинную и среднюю теплоемкости. Истинная
теплоемкость выражается уравнением
(2.2) при определенных параметрах
термодинамического процесса, то есть
в данном состоянии рабочего тела. В
частности, если хотят подчеркнуть
зависимость теплоёмкости рабочего тела
от температуры, то записывают её как
,
а удельную – как.
Обычно под истинной теплоёмкостью
понимают отношение элементарного
количества теплоты, которое сообщается
термодинамической системе в каком-либо
процессе к бесконечно малому приращению
температуры этой системы, вызванному
сообщенной теплотой. Будем считатьистинной
теплоёмкостью термодинамической системы
при температуре системы равной,
а-
истинной удельной теплоёмкостью рабочего
тела при его температуре равной.
Тогда среднюю удельную теплоёмкость
рабочего тела при изменении его
температуры отдоможно
определить как
Обычно в таблицах приводятся средние
значения теплоемкости
для
различных интервалов температур,
начинающихся с.
Поэтому во всех случаях, когда
термодинамический процесс проходит в
интервале температур отдо,
в котором,
количество удельной теплотыпроцесса
определяется с использованием табличных
значений средних теплоемкостейследующим
образом:
|
. |
Значения средних теплоемкостей
и,
находят по таблицам.
Что можно сказать о вычислении теплоемкости?
Вычислить теплоемкость — это задача не из самых простых, особенно если применять исключительно термодинамические методы, точнее это невозможно сделать. Потому физики используют методы статистической физики или же знания микроструктуры продукции. Как произвести вычисления для газа? Теплоемкость газа рассчитывается из вычисления средней энергии теплового движения отдельно взятых молекул в веществе. Движения молекул могут быть поступательного и вращательного типа, а внутри молекулы может быть целый атом или колебание атомов. Классическая статистика говорит, что на каждую степень свободы вращательных и поступательных движений приходится в мольной величина, что равняется R/2, а на каждую колебательную степень свободы значение равняется R. Это правило еще именуют законом равнораспределения.
При этом частичка одноатомного газа отличается всего тремя поступательными степенями свободы, а потому его теплоемкость должна приравниваться к 3R/2, что отлично согласуется с опытом. Каждая молекула двухатомного газа отличается тремя поступательными, двумя вращательными и одной колебательной степенями свободы, а значит, закон равнораспределения будет равняться 7R/2, а опыт показал, что теплоемкость моля двухатомного газа при обычной температуре составляет 5R/2. Почему оказалось такое расхождение теории? Все связано с тем, что при установлении теплоемкости потребуется учитывать разные квантовые эффекты, другими словами, пользоваться квантовой статистикой. Как видите, теплоемкость — это довольно-таки сложное понятие.
Квантовая механика говорит, что любая система частичек, что совершают колебания или же вращения, в том числе и молекула газа, может иметь определенные дискретные значения энергии. Если же энергия теплового движения в установленной системе недостаточна для возбуждения колебаний необходимой частоты, то данные колебания не вносят вклада в теплоемкость системы.
В твердых телах тепловое движение атомов являет собой слабые колебания поблизости определенных положений равновесия, это касается узлов кристаллической решетки. Атом обладает тремя колебательными степенями свободы и по закону мольная теплоемкость твердого тела приравнивается к 3nR,
где n- количество имеющихся атомов в молекуле. На практике это значение является пределом, к которому стремится теплоемкость тела при высоких температурных показателях. Значение достигается при обычных температурных изменениях у многих элементов, это касается металлов, а также простых соединений. Также определяется теплоемкость свинца и других веществ.
Как найти температуру смеси газов
Репетитор по физике
Репетитор по физике
Репетитор по алгебре
Репетитор по физике
Задачи на определение температуры смеси (Задачи на уравнение теплового баланса) .
Задача 1. (Температура смеси) Смешали \(m_=1 кг \) холодной воды при температуре \(t_=10^0C \) и горячую воду при температуре \(t_=90^0C .\) Температура смеси при этом оказалась равна \(\ 50^0 C . \) Какова масса горячей воды? Показать ответ Показать решение Видеорешение
Составим уравнение теплового баланса:
Разделим на \(40\) обе части уравнения:
Разделим на \(c \) обе части уравнения:
Задача 2. (Температура смеси) Смешали \(m_х=1 кг \) холодной воды при температуре \(t_х=10^0C \) и горячую воду при температуре \(t_г=90^0C .\) Температура смеси при этом оказалась равна \(\Theta=50^0 C . \) Какова масса горячей воды? Показать ответ Показать решение Видеорешение
Составим уравнение теплового баланса:
Задача 3. (Температура смеси) Смешали \(m_1=2 кг \) холодной воды при температуре \(t_1=5^0C \) и горячую воду при температуре \(t_2=95^0C .\) Температура смеси при этом оказалась равна \(\Theta=80^0 C . \) Какова масса горячей воды? Показать ответ Показать решение Видеорешение
Удельная теплоемкость обычных веществ
Удельная теплоемкость некоторых распространенных продуктов приведены в таблице ниже.
Онлайн-конвертер единиц удельной теплоемкости
См. также табличные значения для газов, пищевых продуктов и пищевых продуктов, металлов и полуметаллов, обычных жидкостей и жидкостей и обычных твердых тел, а также значения молярной удельной теплоемкости для обычных органических и неорганических веществ вещества.
| Вещество | Удельная теплоемкость – c p – (J/kg C°) | ||
|---|---|---|---|
| Acetals | 1460 | ||
| Air, dry (sea level) | 1005 | ||
| Agate | 800 | ||
| Alcohol, ethyl | 2440 | ||
| Alcohol, metyl wood) | 2530 | ||
| Aluminum | 897 | ||
| Aluminum bronze | 436 | ||
| Alumina, AL 2 O 3 | 718 | ||
| Ammonia, liquid | 4700 | ||
| Ammonia, gas | 2060 | ||
| Antimony | 209 | ||
| Argon | 520 | ||
| Arsenic | 348 | ||
| Artificial wool | 1357 | ||
| Asbestos | 816 | ||
| Asphalt concrete (with aggregate) | 920 | ||
| Barium | 290 | ||
| Barytes | 460 | ||
| Beryllium | 1020 | ||
| Bismuth | 130 | ||
| Boiler scale | 800 | ||
| Кость | 440 | ||
| Бор | 960 | ||
| Нитрид бора 15 904 15 | |||
| Brass | 375 | ||
| Brick | 840 | ||
| Bronze | 370 | ||
| Brown iron ore | 670 | ||
| Cadmium | 234 | ||
| Calcium | 532 | ||
| Силикат кальция, CaSiO 3 | 710 | ||
| Целлюлоза, хлопок, древесная масса и регенерированная | 1300 – 1500 | ||
| Cellulose acetate, molded | 1260 – 1800 | ||
| Cellulose acetate, sheet | 1260 – 2100 | ||
| Cellulose nitrate, Celluloid | 1300 – 1700 | ||
| Chalk | 750 | ||
| Древесный уголь | 840 | ||
| Хром | 452 | ||
| Окись хрома | 750 | Песок 904,0415 | 1381 |
| Cobalt | 435 | ||
| Coke | 840 | ||
| Concrete | 880 | ||
| Constantan | 410 | ||
| Copper | 385 | ||
| Cork | 2000 | ||
| Алмаз (углерод) | 516 | ||
| Дюралий | 920 | ||
| Эмери | 5 | 60 | |
| Epoxy cast resins | 1000 | ||
| Fire brick | 880 | ||
| Fluorspar CaF 2 | 830 | ||
| Dichlorodifluoromethane R12, liquid | 871 | ||
| Dichlorodifluoromethane R12, пар | 595 | ||
| Лед (0 o C) | 2093 | ||
| Индийский каучук | 1250 | ||
| Glass, crown | 670 | ||
| Glass, pyrex | 753 | ||
| Glass-wool | 840 | ||
| Gold | 129 | ||
| Granite | 790 | ||
| Graphite (carbon) | 717 | ||
| Gypsum | 1090 | ||
| Helium | 5193 | ||
| Hydrogen | 14304 | ||
| Ice, snow (-5 o C) | 2090 | ||
| Ingot iron | 490 | ||
| Iodine | 218 | ||
| Iridium | 134 | ||
| Iron | 449 | ||
| Lead | 129 | ||
| Leather | 1500 | ||
| Limestone | 909 | ||
| Lithium | 3582 | ||
| Lucite | 1460 | ||
| Magnesia (Mangnesium oxide), MgO | 874 | ||
| Magnesium | 1050 | ||
| Magnesium alloy | 1010 | ||
| Manganese | 460 | ||
| Мрамор | 880 | ||
| Ртуть | 140 | ||
| Слюда | 880 | ||
| 272 | |||
| Neon | 1030 | ||
| Nickel | 461 | ||
| Nitrogen | 1040 | ||
| Nylon-6 | 1600 | ||
| Nylon-66 | 1700 | ||
| Olive oil | 1790 | ||
| Osmium | 130 | ||
| Oxygen | 918 | ||
| Palladium | 240 | ||
| Paper | 1336 | ||
| Paraffin | 3260 | ||
| Peat | 1900 | ||
| Perlite | 387 | ||
| Phenolic cast resins | 1250 – 1670 | ||
| Phenol- формальдегидные формовочные смеси | 2500 – 6000 | ||
| Фосфорбонз | 360 | ||
| Фосфор | 800 | ||
| Pinchbeck | 380 | ||
| Pit coal | 1020 | ||
| Platinium | 133 | ||
| Plutonium | 140 | ||
| Polycarbonates | 1170 – 1250 | ||
| Polyethylene terephthalate | 1250 | ||
| Полиимидные ароматические соединения | 1120 | ||
| Натуральный полиизопреновый каучук | 1880 | ||
| Polyisoprene hard rubber | 1380 | ||
| Polymethylmethacrylate | 1500 | ||
|
Polypropylene |
1920 | ||
| Polystyrene | 1300 – 1500 | ||
| Polytetrafluoroethylene moulding compound | 1000 | ||
| Политетрафторэтилен (ПТФЭ) | 1172 | ||
| Полиуретановая литая жидкость | 1800 | ||
| Polyurethane elastomer | 1800 | ||
| Polyvinylchloride PVC | 840 – 1170 | ||
| Porcelain | 1085 | ||
| Potassium | 1000 | ||
| Potassium chloride | 680 | ||
| Pyroceram | 710 | ||
| Кварц, SiO 2 | 730 | ||
| Кварцевое стекло | 700 | ||
| Red metal | 381 | ||
| Rhenium | 140 | ||
| Rhodium | 240 | ||
| Rosin | 1300 | ||
| Rubidium | 330 | ||
| Salt, NaCl | 880 | ||
| Песок, кварц | 830 | ||
| Песчаник | 710 | ||
| Selenium | 330 | ||
| Silicon | 705 | ||
| silicon carbide | 670 | ||
| Silver | 235 | ||
| Slate | 760 | ||
| Sodium | 1260 | ||
| Почва сухая | 800 | ||
| Почва влажная | 1480 | ||
| 8 Сажа | 50415 | ||
| Snow | 2090 | ||
| Steatite | 830 | ||
| Steel | 490 | ||
| Sulfur, crystal | 700 | ||
| Tantalium | 138 | ||
| Tellurium | 201 | ||
| Торий | 140 | ||
| Древесина, ольха | 1400 | ||
| Древесина, ясень | 0415 | ||
| Timber, birch | 1900 | ||
| Timber, larch | 1400 | ||
| Timber, maple | 1600 | ||
| Timber, oak | 2400 | ||
| Timber, pitchpine | 1300 | ||
| Timber, Pockwood | 2500 | ||
| Древесина, красная бич | 1300 | ||
| Тимбер, красная скова | |||
| Тимбер, красная сковорода | |||
| . |
|||
| Timber, white pine | 1500 | ||
| Timber, walnut | 1400 | ||
| Tin | 228 | ||
| Titanium | 523 | ||
| Tungsten | 132 | ||
| Tungsten carbide | 171 | ||
| Уран | 116 | ||
| Ванадий | 500 | ||
| Вода чистая (жидкая)0031 o C) | 4182 | ||
| Water, vapor (27 o C) | 1864 | ||
| Wet mud | 2512 | ||
| Wood | 1300 – 2400 | ||
| Zinc | 388 |
- 1 calorie = 4.186 joules = 0.001 Btu/lb m o F
- 1 cal/gram C o = 4186 J/kg o C
- 1 Дж/кг С o = 10 -3 кДж/кг K = 10 -3 Дж/г С o = 10 -6 кДж/г С 9,02038 -4 БТЕ/(фунт м o F)
Для перевода единиц измерения используйте онлайн-конвертер единиц Удельная теплоемкость.![]()
Что называют истинной и средней теплоёмкостью?
Теплоёмкость — это характеристика вещества, которая показывает, сколько тепла нужно передать этому веществу, чтобы его температура изменилась на определенную величину. Существует два типа теплоемкости: истинная и средняя.
Истинная теплоёмкость
Истинная теплоёмкость — это количественная характеристика вещества, которая отражает его способность поглощать или выделять тепло. Истинная теплоёмкость обозначается как С и измеряется в Единицах теплоты на единицу температуры (Дж/°C или Дж/K).
Истинная теплоёмкость зависит от типа вещества и может изменяться в зависимости от условий, таких как давление и состояние вещества (твердое, жидкое или газообразное). Для различных веществ и состояний существуют разные формулы для расчета истинной теплоемкости.
Средняя теплоёмкость
Средняя теплоёмкость — это характеристика, которая определяет количество теплоты, необходимое для изменения температуры определенного количества вещества на определенную величину при постоянном давлении. Средняя теплоёмкость обозначается как Сp и также измеряется в Единицах теплоты на единицу температуры (Дж/°C или Дж/K).
Средняя теплоемкость может быть рассчитана по формуле:
Сp = (Q / (m * ΔT))
где Cp — средняя теплоемкость, Q — количество тепла, m — масса вещества, ΔT — изменение температуры.
Различие между средней истинной теплоемкостью заключается в том, что средняя теплоемкость рассчитывается при постоянном давлении, а истинная теплоемкость учитывает изменение давления.
Заключение
Истинная и средняя теплоемкость — это важные показатели для изучения свойств вещества и расчета теплового равновесия системы. Истинная теплоемкость учитывает различные факторы, такие как давление и состояние вещества, в то время как средняя теплоемкость упрощает расчеты, предполагая постоянное давление. Оба понятия имеют большое значение в научных и инженерных исследованиях, а также в промышленности.
- А как парня нужно целовать, чтобы он был от поцелуя без ума: советы и рекомендации
- Если ВСЁ в торрент-программе закачано — что тогда качается?
- Иж Планета 5 и 3: есть ли отличие в КПП?
- Какая скорость приемлема для путешествия по нашей системе, если скорость некоторых объектов выше 200 км в секунду?
- Для чего на электровозе два токоприемника (пантографа), и почему при движении поднят не передний, а задний?
- Не открываются все Приложения и игры.
- Госдума приняла закон, повышающий МРОТ до уровня прожиточного минимума
- А вот если что-то долго искал, а потом возникают миражи: как понять, что это реальность или показалось?
Истинная и средняя теплоемкости.
тела)(6-1)、(6-3)、(6-4) теплоемкость, определяемая, называется истинной теплотой capacity. So, истинная теплоемкость — это термодинамической системе в любом процессе, к небольшой разнице температур. Истинная теплоемкость реального газа может быть
представлена в виде суммы 2-х членов. СХ = новинки• «Первый член-это удельная теплоемкость конкретного газа в разреженном (в идеале газовом) состоянии (P0 или Vo) и зависит только от температуры. Температурная зависимость удельной емкости (cp) и (cv) может быть приблизительно представлена в виде полинома 3-го порядка t°С.
СХО-00+AXT + a42 + A3t’■’ * » Однако в настоящее время при расчете используется более точное табличное значение. «» 2-й член Дсх определяет зависимость теплоемкости от давления или удельного объема и связан с изменением потенциальной составляющей внутренней энергии реального газа. 。В фактическом расчете, при
определении количества тепла, нагреватель обычно использует так называемую среднюю теплоемкость. в температурном диапазоне (от r до t2) средней теплоемкостью КСК этого процесса называют отношение количества теплоты d1-2 к температуре t2-t, которое является конечной разностью. З И я ., (6-24)) Тепло Q \ .Поскольку
он равен 2, то x, полученный системой в процессе x = const, определяется выражением (6-2). З (6-25) устанавливает зависимость между средней теплоемкостью тела и истинной теплоемкостью в этом процессе. Если средняя теплоемкость показана в таблице в диапазоне
температур от 0 до f C, то среднюю теплоемкость можно рассчитать по следующей формуле: 。 a = CX fc / 2 — <W0’h ^ 6.26) СХ ДТ— cxch ХТИ * ч-т Фактически Интеграл уравнения (6-25), основанный на известном в математике правиле, можно разделить на следующие интегралы. И затем кросслинкинг * = — (’cxdt =- ’Н J’ * О! ty. \ cxdt =
цефуроксиму / 2,а \ cxdt cxrn ^ Жо ’0′ 0 Подставляя найденное интегральное значение в уравнение(6-25), получаем уравнение(6-26). Итак, если в определенном процессе идеальный газ нагревается от температуры tx до t2, то количество теплоты, затрачиваемое на нагревание Модель QX = м =(6-27)) в таблице приведены средние значения молярной, массовой и объемной теплоемкости газов при p =
и v = const. Приложение болезни, iv, v, vi, vii, vii, viii. Отношение теплоемкости cv к cb термодинамика qacjo использует отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме, обычно обозначаемое буквой k:%. к-СЈ, LCV по-СР / с з — [КЧР / \ 1C0. Согласно классической кинетической теории газов,
величина k определяется числом степеней свободы молекулы. Из формул(6-21) и (6-22)、 к = ч: р = 1 + Ж ’(6-28) при рассмотрении cx-const, из таблицы. 6.1 приобретение: для одноатомных газов k = 1.66.Для двухатомного газа£ = 1,4, для трехатомного и многоатомного газа k = 1,33. Идеальный газ cxΦconst k зависит от температуры. Это видно из Формулы. СР / СV =(СС + Р) / СС = 1 + Р / С0 Из уравнения Мейера можно получить следующее соотношение для удельной теплоты и cf. Ко Р /(К-1); АВ = КР /(к-1). (6-29))
| Определение количества теплоты. | Приближенные значения теплоемкостей. |
| Элементы молекулярно-кинетической и квантовой теории теплоемкости. | Тепловая Ts-диаграмма. |
Какое вещество больше всего подходит для теплоаккумулятора?

Наилучшим продуктом для теплоаккумулятора является совсем не бетон и кирпич! Неплохо с этой задачей справляется медь, бронза и железо, но они очень тяжелые. Как ни странно, но лучший теплоаккумулятор — вода! Жидкость имеет внушительную теплоемкость, самую большую среди доступных нам веществ. Больше теплоемкость только у газов гелия (5190 Дж/(кг·К) и водорода (14300 Дж/(кг·К), но их проблематично применять на практике. При желании и необходимости смотрите таблицу теплоемкости нужных вам веществ.
–
это количество
теплоты, подведенное к 1 кг вещества при
изменении его температуры от Т
1
до Т
2 .
Средняя теплоемкость. Вычисление количества теплоты через средние табличные теплоемкости
Среднюю теплоемкость газа для любого диапазона температур и соответствующее количество тепла cf или s можно найти, используя таблицу средней молярной теплоемкости таблица 4.1, которая показывает среднюю теплоемкость различных газов от СГС 273 к до диапазона температур или 7к. Рисунок 4. 1 кривая А12 показывает температурную зависимость истинной теплоемкости.
Количество тепла, которое газ получает при нагревании от температуры
Т1 до температуры Т2, рассчитывается по формуле с площадью с12а 4.
12 как показано на этом графике. Эту область можно представить как
разность между областями bA2 1 и bA1c. это не более чем количество
тепла, которое газ получает при нагревании от 273 к до температур
G2 и 7 1. пл.
Площадь LA2c1-площадь м с Или Ять — 273 В зависимости от величины средней теплоты таблица г. Емкость для расчета ССР 3 Р с 3 с-273 3 — а-273 Г, −273 — с 3 Г, −273.Таблица 4.1 Средняя молярная теплоемкость газа при постоянном давлении в диапазоне температур от 0 до 1.Используя эту формулу напрямую, вы можете рассчитать количество тепла в диапазоне температур 72 7. это выглядит немного упрощенно, когда разница температур выражается в масштабе Цельсия, а не в абсолютном масштабе. Значение 1 градуса обеих шкал одинаково, поэтому значение разности температур ns изменяется при переходе к шкале Цельсия 2-6 Г2-273 — Г1-273 Г2 71.
Возьми MF o, 12 вода o 6 Средняя теплоемкость интервала a — указывает
на эту среднюю теплоемкость. Где ССР Р 2- 2 р Количество теплоты
в NT 4 соответствует площади прямоугольника SM, 0C1 VAH
и hX соответствует разности. Температура 1 г с Средняя теплоемкость
СР Г1 Рисунок 4. 1.Изменение истинной теплоемкости идеального газа
в зависимости от температуры.
Корреляция между истинной и средней теплоемкостью Средняя
теплоемкость, то есть теплоемкость в диапазоне температур от 273 к
до 7 cfr , 73.T2 cfr T отображается на графике высотой C
и bm прямоугольный bf с равной площадью. Юм Лигур М С и ЛА2 1. При
нагревании от 273 K до Tu и 273 K до Tg каждый из них представляет собой
количество тепла, которое получает газ. График показывает, что средняя
теплоемкость равна int.
Диапазон температур всегда выше, чем средняя теплоемкость таблицы между 273 K и границей интервала. Для таблицы средняя теплоемкость в диапазоне значений s, p1 FPPMula 4-15 показывает значения удельного количества тепловой энергии, генерируемой ведомым устройством. Body. To получите полное количество тепла, вам нужно значение Масса, Объем при нормальных условиях или умноженное на молярное число газа. Гс 2 22 — J.
Методические указания по теплотехнике
| Массовая, объемная и мольная теплоемкости | Теплоемкость смеси газов |
| Зависимость теплоемкости идеального газа от температуры. Истинная теплоемкость. Вычисление количества теплоты через истинную теплоемкость | Уравнения процесса |
Чем отличаются объемные и мольные теплоемкости воздуха?
Объемная теплоемкость- это количество
теплоты , которую необходимо подвести
к 1 м3 вещества ,чтобы нагреть его на 1
С,измеряется в (Дж/м3 К)
Мольная теплоемкость- это количество
теплоты, которую необходимо подвести
к 1молю вещества, чтобы нагреть его на
1 С, измеряется в (Дж/моль К)
μСр- средняя мольная теплоемкость при
постоянном давлении.
μСv- средняя мольная
теплоемкость при постоянном объеме.
μСр= μСv+μR,
кДж/(кмоль∙град)
теплоемкость газов зависит от их
температуры. Приближенно можно считать:
μСv=а+вТ,
где коэффициенты а и в для каждого газа
имеют свои значения.
Для увеличения мощности применяют
наддув. При наддуве повышается наполнение
цилиндра свежим зарядом и тем самым
увеличивается давление у всасывающих
клапанов что способствует возрастанию
мощности. Мощность повышается
пропорционально степени наддува.
При наддуве мощность увеличивается в
20…30% без изменения конструкции двигателя.
29. Выведите аналитического выражения для определения коэффициента наполнения.
Для сравнения ДВС с различными рабочими
объемами используют коэффициент
наполнения, представляющий отношение
количества воздуха, фактически
поступившего в цилиндр двигателя, к
количеству воздуха, которое могло бы
заполнить его рабочий объем Vh при температуре и давлении окружающей
среды
Ма=Мо+Мr,
где Ma– количество молей рабочей смеси в точке
«а»;
Мо– количество молей
свежего заряда;
Mr– количество молей остаточных газов.
Вынося Моза скобки и
обозначивМrMo=r(коэффициент остаточных газов), получаем:
Ма=Мо(1+r).
Т.к.paVa=MaRTa*;
иpoVo=MoRTo,
то:
.
Подставив вместо Vo=vVh, получим:
Учтя, что 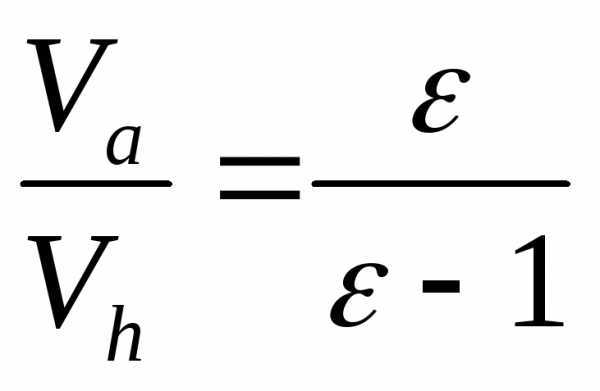
.
(4)
С учетом ранее полученного значения Таможно записать и такое выражение для
определения коэффициента наполнения:
,
(5)
В этих формулах: роиТо– давление и температура (в ДВС без
наддува – окружающей среды, а с наддувом
– после компрессора).
Отсюда следует, что на vвлияют подогрев зарядаtcm,
температура Тои
давлениероокружающей
среды. Влияют на него такжеиr.
С увеличением tcm,
т.е. степени подогрева смеси, v уменьшается. Так, увеличение ееот 5
до 20° снижает в некоторых двигателях v с 0,88 до 0,8 (почти на 10%).
30. Что из себя представляет круговые диаграммы фаз газораспределения двигателя?
Периоды
выраженные в градусах поворота коленчатого
вала в течение которых клапаны открыты,
называют фазами газораспределения. При
правильном выборе фаз не только улучшается
очистка цилиндров от продуктов сгорания
и заполнение его свежим зарядом, но и
может несколько сократиться затрата
энергии на газообмен, которая
пропорциональна разности давлений в
цилиндре в течение процессов выпуска
и впуска. 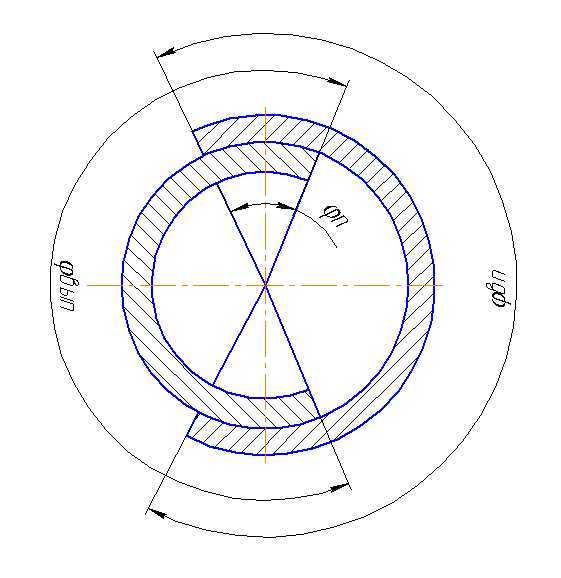
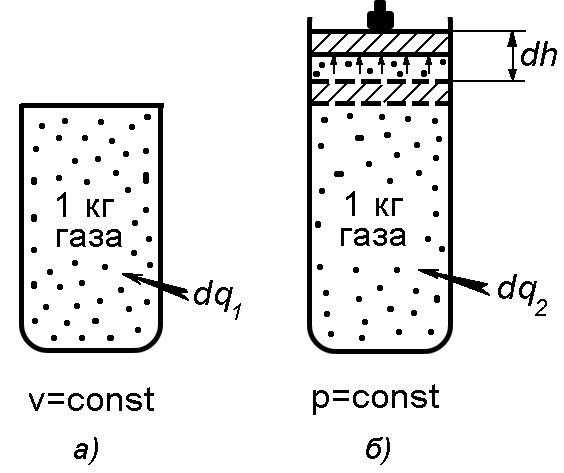
А) Влияние типа термодинамического процесса на теплоемкость газа
Количество теплоты,
необходимое для нагревания одного и
того же количества газа в одном и том
же диапазоне температур, зависит от
типа термодинамического процесса,
совершаемого газом.
|
|
В
изохорном процессе
υ
а
с
υ
В
изобарном
процессе
(р
= const)
теплота
тратится не только на нагрев газа на ту
же величину,
что и в изохорном процессе, но и на
совершение им работыпри поднятии поршня с площадьюна величину(рис. 1.2б
).
Теплоемкость газа в изобарном процессе
обозначается символом с
р
.
Так как по условию
в обоих процессах величина
одинакова, то в изобарном процессе за
счет совершения газом работывеличина.
Поэтому в изобарном процессе теплоемкостьс
р
с
υ
.
В соответствии с
формулой Майера для идеального
газа
или.
(1.6)