Формула и соединения
АРЕНЫ (АрУ)– карбоциклические соединения, содержащие в молекуле специфическую систему чередующихся двойных и одинарных связей (сопряженных π-связей).
Ароматические углеводороды (Арены) являются ненасыщенными циклическими соединениями и представлены в нефтях следующими углеводородами:
- моноциклическими (бензольными) – СnНn;
- бициклическими (нафталиновыми) – СnНn-2;
- трициклическими (антраценовыми) – СnНn-4
- тетрациклическими (пиреновыми) – СnНn-6.
В основном все они представлены алкилпроизводными изомерами и содержатся во фракциях нефти в соответствии с их температурами кипения.
В среднем для нефтей характерно следующее соотношение этих групп углеводородов:
- бензольные – 67%,
- нафталиновые – 18%,
- фенантреновые – 8%,
- пиреновые – 5%,
- прочие – 2%.
Страницы
Главная страницаОСНОВЫ ОБЩЕЙ ХИМИИ1.1 Важнейшие классы неорганических веществ2.1 Вещества. Атомы2.2 Размеры атомов2.3 Молекулы. Химические формулы2.4 Простые и сложные вещества2.5 Валентность элементов2.6 Моль. Молярная масса2.7 Закон Авогадро2.8 Закон сохранения массы веществ2.9 Вывод химических формул3.1 Строение атома. Химическая связь3.2 Строение атома3.4 Строение электронной оболочки атома3.5 Периодическая система химических элементов3.6 Зависимость свойств элементов3.7 Химическая связь и строение вещества3.8 Гибридизация орбиталей3.9 Донорно-акцепторный механизм образования3.10 Степени окисления элементов4.1 Классификация химических реакций4.2 Тепловые эффекты реакций4.3 Скорость химических реакций4.4 Необратимые и обратимые реакции4.5 Общая классификация химических реакцийНЕОРГАНИЧЕСКАЯ ХИМИЯ5.1 Растворы. Электролитическая диссоциация5.2 Количественная характеристика состава растворов5.3 Электролитическая диссоциация5.4 Диссоциация кислот, оснований и солей5.5 Диссоциация воды5.6 Реакции обмена в водных растворах электролитов5.7 Гидролиз солей6.1 Важнейшие классы неорганических веществ6.2 Кислоты, их свойства и получение6.3 Амфотерные гидроксиды6.4 Соли, их свойства и получение6.5 Генетическая связь между важнейшими классами6.6 Понятие о двойных солях7.1 Металлы и их соединения7.2 Электролиз7.3 Общая характеристика металлов7.4 Металлы главных подгрупп I и II групп7.5 Алюминий7.6 Железо7.7 Хром7.8 Важнейшие соединения марганца и меди8.1 Неметаллы и их неорганические соединения8.2 Водород, его получение8.3 Галогены. Хлор8.4 Халькогены. Кислород8.5 Сера и ее важнейшие соединения8.6 Азот. Аммиак. Соли аммония8.7 Оксиды азота. Азотная кислота8.8 Фосфор и его соединения8.9 Углерод и его важнейшие соединения8.10 Кремний и его важнейшие соединенияОРГАНИЧЕСКАЯ ХИМИЯ9.1 Основные положения органической химии. Углеводороды9.2 Электронные эффекты заместителей в органических соединениях9.3 Предельные углеводороды (алканы)9.3.1 Насыщенные УВ. Метан9.4 Понятие о циклоалканах9.5 Непредельные углеводороды9.6 Диеновые углеводороды (алкадиены)9.7 Алкины9.8 Ароматические углеводороды9.9 Природные источники углеводородов10.1 Кислородсодержащие органические соединения10.2 Фенолы10.3 Альдегиды10.4 Карбоновые кислоты10.5 Сложные эфиры. Жиры10.6 Понятие о поверхностно-активных веществах10.7 Углеводы11.1 Амины. Аминокислоты11.2 Белки11.3 Понятие о гетероциклических соединениях11.4 Нуклеиновые кислоты12.1 Высокомолекулярные соединения12.2 Синтетические волокна▼
Получение и очистка
Как уже было описано выше, впервые бензойную кислоту выделили из росного ладана. Это природное соединение представляет собой смолу стираксового дерева. Для этого измельчённое сырье прогревали на песчаной бане и собирали сублимирующиеся кристаллы в небольшом ящичке, оклеенном бумагой. Полученный продукт имел приятный аромат из-за присутствия эфирных масел в росном ладане – коричного и ванильного.

Также использовался метод взаимодействия гиппуровой кислоты с соляной при сильном нагревании. Первую получали путём упаривания мочи травоядных, затем очищали кристаллизацией до исчезновения характерного запаха. А как же протекает современный синтез такого вещества как бензойная кислота? Получение её очень дешёво, просто и экологично. Его проводят при помощи промышленного оксидирования метилбензола KMnO4, либо частичным взаимодействием исходного реагента с O2. Очистка сырья основана на физических свойствах реактива — низкой растворимости бензойной кислоты в холодной воде и высокой — в горячей, и называется перекристаллизацией.
Химические свойства анилина
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора!!!
Видеоопыт «Изучение среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях:
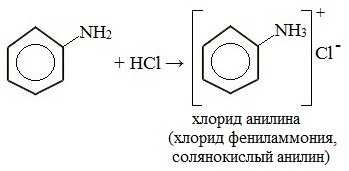
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
![]()
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
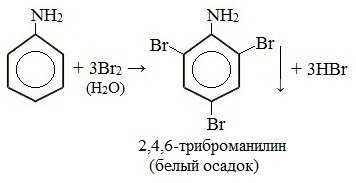
Качественная реакция на анилин!
Видеоопыт «Бромирование анилина»
2. Сульфирование
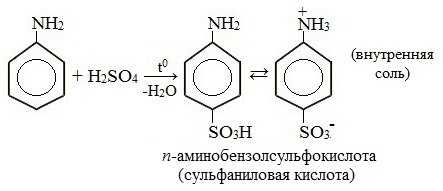
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей»
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.
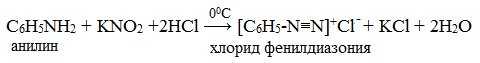
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
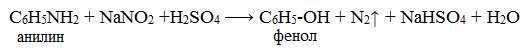
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Рубрики: Амины Теги: Амины
Номенклатура
Название кислот образуется так, что к названию предельного углеводорода прибавляется
-овая кислота.
|
Формула алкана |
Название алкана |
Формула кислоты |
Название кислоты. |
|
СН4 |
метан |
НСООН |
метановая кислота (муравьиная) |
|
С2Н6 |
этан |
СН3СООН |
этановая кислота (уксусная) |
|
С3Н8 |
пропан |
С2Н5СООН |
пропановая кислота (пропионовая) |
5,5-диметилгексановая кислота
2-этилбутановая кислота
пентан-3-карбоновая кислота
3-карбокси-3-гидроксипентандиовая-1,5 кислота (лимонная)
Тривиальные названия важнейших кислот
Алифатические предельные одноосновные кислоты:
НСООН муравьиная
СН3СООН уксусная
С2Н5СООН пропионовая
С3Н7СООН масляная
С5Н11СООН валериановая
С6Н13СООН капроновая
С15Н31СООН пальмитиновая
С17Н35СООН стеариновая
Непредельные кислоты:
СН2=СН-СООН акриловая
СН3-(СН2)7-СН=СН-(СН2)7-СООН олеиновая
Ароматические кислоты:
С6Н5COOH бензойная
Двухосновные кислоты:
НООС-СООН щавелевая
НООС-СН2-СООН малоновая
Применение
Бензол в основном идет на производство этилбензола, из которого каталитическим дегидрированием при 600 °С получают стирол – исходный мономер для производства каучуков и ценных полимеров:
Для производства других ценных продуктов – фенола и ацетона пользуют кумол (изопропилбензол), который окисляют в пероксид, разложением которого кислотой получают фенол и ацетон.
Из кумола каталитическим дегидрированием получают такой ценный мономер для производства каучуков, как α-метилстирол.
Значение АрУ в нефтепродуктах различно. Так, в бензинах присутствие (до 30% масс.) желательно и необходимо, так как придает бензинам хорошие моторные свойства – повышает детонационную стойкость. С этой целью в товарные бензины часто добавляют толуол или ксилолы.
В авиационных керосинах содержание АрУ ограничивают (в зависимости от марки топлива) 10-20% масс. из-за их низкой теплоты сгорания и способности давать нагар в двигателе сгорании. Допустимое количество АрУ обусловлено необходимостью иметь авиакеросины с повышенной плотностью.
В дизельных топливах содержание АрУ ограничивают из-за их нагарообразующих свойств и плохой воспламеняемости является очень важной характеристикой этих топлив. В маслах высокомолекулярные и алкилсодержащие АрУ с боковыми цепями изомерного строения – нежелательный компонент, так как они ухудшают вязкостно-температурную характеристику масел (индекс вязкости) и обусловливают образование лаково-смолистых отложений на трущихся поверхностях
АрУ удаляют из масел в процессе очистки масляных дистиллятов и деасфальтизатов. Остаются в маслах лишь АрУ с длинными боковыми цепями и “гибридные” полициклические углеводороды, в которых преобладают насыщенные циклы, поскольку свойства углеводородов приближаются соответственно к свойствам алканов и цикланов.
Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
|
Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду.
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2+: |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
либо п-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Гомологический ряд, номенклатура, изомерия
Для того чтобы вывести общую формулу гомологического ряда бензола, сравним, как всегда, состав алкана и бензола, у которых число атомов углерода одинаково:
Гомологи бензола (арены) должны отвечать формуле СnН2n–6 и содержать одно бензольное кольцо (остаток бензола). Так как у бензола состав C6H6, то ближайший гомолог бензола имеет семь атомов углерода в молекуле:
Вопрос. Существуют ли ароматические изомеры толуола, т. е. можно ли получить новое соединение, «перемещая» метильную группу (СН3) по кольцу?
Поскольку все атомы углерода равноценны, — изомеров ароматического строения у толуола нет и обозначать цифрой положение метильной группы не имеет смысла.
Если n = 8, то составу С8Н10 отвечают несколько формул:
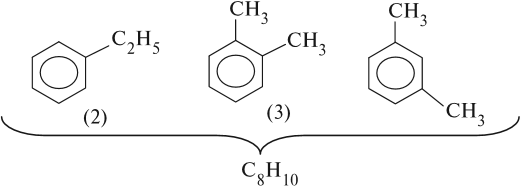
В местах соединения атомов углерода бензольного кольца и радикалов атомов водорода нет!
Вопрос. От чего будет зависеть изомерия таких ароматических соединений?
Очевидно, что для вещества (3) возможны ещё два изомера, которые отличаются взаимным расположением метильных групп. В этом случае положение метильной группы нужно показывать цифрой. Цифрой 1 нумеруют любую метильную группу и, двигаясь по кольцу в сторону ближайшей группы, расставляют остальные номера:
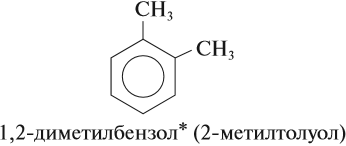
Задание 21.2. Составьте формулы остальных гомологов бензола с n = 8. Назовите полученные изомеры. Назовите также соединение (2).

Окисление под действием КМnO4, К2Сr2O7, HNO3 и др.
Не происходит химической реакции (сходство с алканами).
Свойства гомологов бензола
В гомологах бензола различают ядро и боковую цепь (алкильные радикалы).
По химическим свойствам алкильные радикалы подобны алканам; влияние бензольного ядра на них проявляется в том, что в реакциях замещения всегда участвуют атомы водорода у атома углерода, непосредственно связанного с бензольным ядром, а также в более легкой окисляемости С-Н связей.
Влияние электронодонорного алкильного радикала (например, -СН3) на бензольное ядро проявляется в повышении эффективных отрицательных зарядов на атомах углерода в орто- и пара-положениях; в результате облегчается замещение связанных с ними атомов водорода.
Поэтому гомологи бензола могут образовывать тризамещенные продукты (а бензол обычно образует монозамещенные производные).
Ароматические углеводороды. Бензол, структурная формула, строение, свойства. Применение бензола и его гомологов.
Ароматические углеводороды – циклические органические соединения, которые имеют в своём составе ароматическую систему.
Имеют общую формулу СnH2n-6. Особенностью аренов является наличие бензольного кольца и ароматической связи.
— структурная формула
Тип sp2-гибридизации, негибридные электроны образуют единую π-систему (ароматическую связь). Эту систему изображают в формуле в виде кольца.
Бензол- это бесцветная жидкость со специфическим запахом. В воде не растворим. Сам бензол является хорошим растворителем для многих органических веществ.
Горит коптящим пламенем, так как содержит большое количество углерода в молекуле. Получить бензол можно тримеризацией ацитилена:
3C2H2àC6H6
Применение
1.Производство растворителей
2.Добавка к бензину
3.Производство органических соединений
Основные положения теории химического строения органических веществ А.М.Бутлерова. Химическое строение как порядок соединения и взаимного влияния атомов в молекуле.
В своей теории Александр Михайлович Бутлеров обобщил опыт и знания ученых органиков того времени и объяснил строение молекул органических веществ. Это теория играет важную роль в объяснении строения и свойств всех органических веществ.
Основные положения теории химического строения веществ А.М. Бутлерова.
- Атомы в органический молекулах реально существуют. Доказательством служит получение искусственным путем органический веществ из неорганических.
- Соединения атомов в молекулах веществ происходит в определенной последовательности их валентности.
- Свойства вещества зависят от строения их молекул.
- По свойствам вещества можно определить его строение, а по строению — свойства.
- Атомы и группы атомов взаимно влияют друг на друга.
Изомерия органических веществ, ее виды.
Изомерия- это явление существование разных веществ- изомеров, имеющих одинаковый состав, но разные свойства и строение.
Различают два основных вида изомерии:
- Структурная (различный порядок связей между атомами в молекуле)
- Пространственная (расположение атомов в пространстве при одинаковом порядке связей между ними)
Структурная изомерия подразделяется на несколько разновидностей.
Изомерия углеродного скелета.
Примеры решения задач
ПРИМЕР 1
| Задание | Запишите уравнения, с помощью которых можно осуществить следующие превращения: CH 4 → C 2 H 2 → C 6 H 6 → C 6 H 5 Cl. |
| Решение |
Для получения ацетилена из метана используют следующую реакцию:
2CH 4 → C 2 H 2 + 3Н 2 (t = 1400C). Получение бензола из ацетилена возможно по реакции тримеризации ацетилена, протекающей при нагревании (t = 600C) и в присутствии активированного угля: 3C 2 H 2 → C 6 H 6 . Реакция хлорирования бензола с получением в качестве продукта хлорбензола осуществляется в присутствии хлорида железа (III): C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl. |
ПРИМЕР 2
| Задание | К 39 г бензола в присутствии хлорида железа (III) добавили 1 моль бромной воды. Какое количество вещества и сколько граммов каких продуктов при этом получилось? |
| Решение |
Запишем уравнение реакции бромирования бензола в присутствии хлорида железа (III):
C 6 H 6 + Br 2 → C 6 H 5 Br + HBr. Продуктами реакции являются бромбензол и бромоводород. Молярная масса бензола, рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – n(C 6 H 6) = m(C 6 H 6) / M(C 6 H 6); n(C 6 H 6) = 39 / 78 = 0,5 моль. По условию задачи бензол вступил в реакцию с 1 моль брома. Следовательно, бензол находится в недостатке и дальнейшие расчеты будем производить по бензолу. Согласно уравнению реакции n(C 6 H 6): n(C 6 H 5 Br) : n(HBr) = 1:1:1, следовательно n(C 6 H 6) = m(C 6 H 5 Br) = n(C 6 H 5 Br)×M(C 6 H 5 Br); m(HBr) = n(HBr)×M(HBr). Молярные массы бромбензола и бромоводорода, рассчитанные с использованием таблицы химических элементов Д.И. Менделеева – 157 и 81 г/моль, соответственно. m(C 6 H 5 Br) = 0,5×157 = 78,5 г; m(HBr) = 0,5×81 = 40,5 г. |
| Ответ | Продуктами реакции являются бромбензол и бромоводород. Массы бромбензола и бромоводорода – 78,5 и 40,5 г, соответственно. |
Взаимодействие
Карбоновые кислоты изменяют окраску индикаторов. Лакмус и метилоранж становятся красными.
Рис. 2. Взаимодействие с индикаторами.
В таблице химических свойств карбоновых кислот описано взаимодействие кислот с другими веществами.
|
Реакции |
Результат |
Пример |
|
С металлами |
Выделяется водород, образуются соли |
2CH3COOH + Mg → (CH3COO)2Mg + H2 |
|
С оксидами |
Образуются соль и вода |
2CH3COOH + ZnO → (CH3COO)2Zn + H2O |
|
С основаниями (нейтрализация) |
Образуются соль и вода |
CH3COOH + NaOH → CH3COONa + H2O |
|
С карбонатами |
Выделяются углекислый газ и вода |
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2 |
|
С солями слабых кислот |
Образуется неорганическая кислота |
2CH3COOH + Na2SiO3 → 2CH3COONa + H2SiO3 |
|
С аммиаком или гидроксидом аммония |
Образуется ацетат аммония. При взаимодействии с гидроксидом выделяется вода |
CH3COOH + NH3 → CH3COONH4 CH3COOH + NH4OH → CH3COONH4 + H2O |
|
Со спиртами (этерификация) |
Образуются сложные эфиры |
CH3COOH + C2H5OH → CH3COOC2H5 + H2O |
|
Галогенирование |
Образуется соль |
CH3COOH + Br2 → CH2BrCOOH |
Соли, образующиеся при взаимодействии веществ с муравьиной кислотой, называются формиатами, с уксусной кислотой – ацетатами.
Получение карбоновых кислот
Некоторые карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная, уксусная, масляная, валериановая и др.). Однако, основным источником карбоновых кислот является органический синтез. Рассмотрим основные способы получения карбоновых кислот
Общие способы получения карбоновых кислот
1. Окисление первичных спиртов и альдегидов под действием различных окислителей
Окисление спиртов
В качестве окислителей применяют KMnO4 и K2Cr2O7.
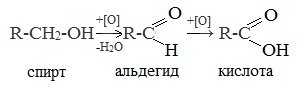
Например:
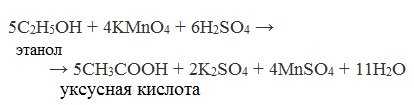
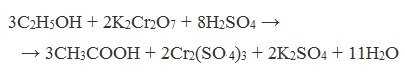
Окисление альдегидов
Для окисления альдегидов используются те же реагенты, что и для спиртов.
При окислении перманганатом калия происходит обесцвечивание фиолетово-розового раствора.
При окислении дихроматом калия — цвет меняется с оранжевого на зеленый.

А также для них характерны реакции «серебряного зеркала» и окисление гидроксидом меди (II) – качественные реакции альдегидов:
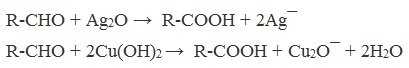
2. Гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода
В результате реакции образуются спирты, содержащие три группы ОН у одного атома углерода. Такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:
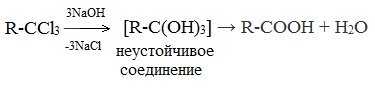
3. Получение карбоновых кислот из цианидов (нитрилов)
Этот способ позволяет наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия:
![]()
Образующийся нитрил уксусной кислоты CH3-CN (ацетонитрил, метилцианид) при нагревании гидролизуется с образованием ацетата аммония:
При подкислении раствора выделяется кислота:
![]()
4. Использование реактива Гриньяра (по схеме)
![]()
5. Гидролиз галогенангидридов кислот
С водой низшие хлорангидриды реагируют чрезвычайно энергично, образуя соответствующую карбоновую кислоту и соляную кислоту:
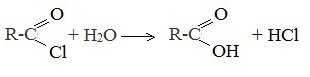
В промышленности
1. Выделяют из природных продуктов
(жиров, восков, эфирных и растительных масел)
2. Окисление алканов кислородом воздуха ( в присутствии катализаторов – солей марганца или при нагревании под давлением)
Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:
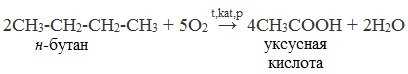
3. Окисление алкенов и алкинов
При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
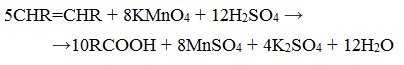
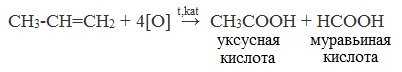
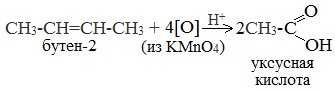
При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:
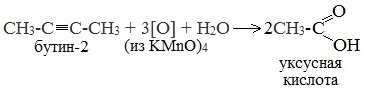
4. Окисление гомологов бензола (получение бензойной кислоты)
Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия:
![]()
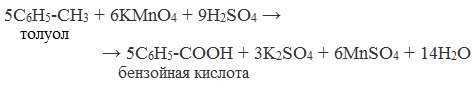
В лаборатории
1. Гидролиз сложных эфиров
При кислотном гидролизе получают карбоновые кислоты и спирты (реакция обратная этерификации):
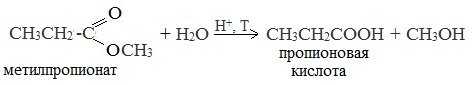
2. Из солей карбоновых кислот
![]()
3. Гидролиз ангидридов кислот
При легком нагревании с водой ангидриды образуют соответствующие карбоновые кислоты:
4. Щелочной гидролиз галоген производных карбоновых кислот
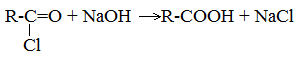
Специфические способы получения важнейших кислот
Способы получения НСООН
1. Взаимодействие оксида углерода (II) с гидроксидом натрия
Муравьиную кислоту получают нагреванием под давлением гидроксида натрия и оксида углерода (II) под давлением и обработкой полученного формиата натрия серной кислотой:
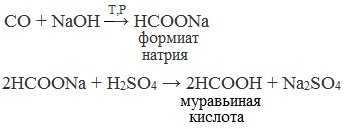
2. Каталитическое окисление метана
3. Декарбоксилирование щавелевой кислоты
Муравьиную кислоту можно получить при нагревании щавелевой кислоты:
Способы получения СН3СООН
Получение уксусной кислоты для химических целей
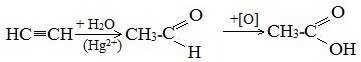
1. Синтез из ацетилена
Данный способ получения уксусной кислоты основан на окислении уксусного альдегида, который в свою очередь получают из ацетилена по реакции Кучерова (ацетилен получают из очень доступного сырья — метана):
2. Каталитическое окисление бутана
Большое значение имеет способ получения уксусной кислоты, основанный на окислении бутана кислородом воздуха:
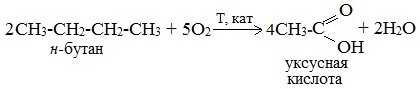
Процесс получения уксусной кислоты из метана является многостадийным (метан – ацетилен – уксусный альдегид – уксусная кислота). Ее получение окислениям будана сокращает число стадий, что дает большой экономический эффект.
3. Каталитическое карбонилирование метанола
Получение уксусной кислоты для пищевых целей
4. Уксуснокислое брожение этанола
Уксусную кислоту для пищевых целей получают уксуснокислым брожением жидкостей, содержащих спирт (вино. пиво):
![]()
Рубрики: Карбоновые кислоты Теги: Карбоновые кислоты
Строение бензола
Углерод в составе ароматических углеводородов образует правильный шестиугольник. Иногда при записи уравнений реакций его изображают вытянутым в вертикальном направлении. Эта группа атомов получила специальное название – бензольное ядро. Подтверждением циклического строения бензола является его получение из трех молекул ацетилена – непредельного углеводорода с тройной связью. Ароматические углеводороды тоже являются непредельными и проявляют некоторые свойства, характерные для алкенов. По этой причине в бензольном кольце тремя черточками, идущими параллельно граням, отмечают наличие двойной связи. Такая формула бензола не в полной мере отражает состояние углеродных атомов в молекуле.
В реальности связи между углеродом в кольце равноценны между собой. Среди них не удалось выделить одинарные и двойные. Объясняется такая особенность электронным строением бензола, при котором углерод в ядре находится в sp2-гибридизованном состоянии, соединен с соседями по кольцу и водородом тремя обычными одинарными связями. В этом случае возникает шестиугольник, в котором находятся в одной плоскости 6 атомов углерода и 6 — водорода. Только электронные облака четвертых p-электронов, не участвующих в гибридизации, расположены иначе. Их форма напоминает гантели, центр приходится на плоскость кольца. А утолщенные части находятся сверху и снизу. В таком случае над бензольным ядром и под ним расположены две электронные плотности, возникшие при перекрывании облаков p-электронов. Возникает общая химическая связь для углерода в кольце.
Химические свойства ароматических углеводородов
Ароматический характер связи влияет на химические свойства бензолов и других ароматических углеводородов.
Единая 6пи–электронная система намного более устойчива, чем обычные пи-связи. Поэтому для ароматических углеводородов более характерны реакции замещения, а не присоединения. В реакции замещения арены вступают по электрофильному механизму.
Реакции замещения
Галогенирование
Нитрование
Лучше всего реакция нитрования протекает под действием не чистой азотной кислоты, а ее смеси с концентрированной серной кислотой, так называемой нитрующей смеси:
Алкилирование
Реакция при которой один из атомов водорода при ароматическом ядре замещается на углеводородный радикал:
Также вместо галогенпроизводных алканов можно использовать алкены. В качестве катализаторов можно использовать галогениды алюминия, трехвалентного железа или неорганические кислоты.<
Реакции присоединения
Присоединение хлора
Протекает по радикальному механизму при интенсивном облучении ультрафиолетовым светом:
Подобным образом реакция может протекать только с хлором.
Реакции окисления
Неполное окисление
Бензольное кольцо устойчиво к действию таких окислителей как KMnO4 и K2Cr2O7. Реакция не идет.
Галогенирование
Молекулу толуола можно рассматривать, как состоящую из фрагментов молекул бензола и метана. Поэтому логично предположить, что химические свойства толуола должны в какой-то мере сочетать химические свойства этих двух веществ, взятых по отдельности. В частности, именно это и наблюдается при его галогенировании. Мы уже знаем, что бензол вступает в реакцию замещения с хлором по электрофильному механизму, и для осуществления данной реакции необходимо использовать катализаторы (галогениды алюминия или трехвалентного железа). В то же время метан так же способен реагировать с хлором, но уже по свободно-радикальному механизму, для чего требуется облучение исходной реакционной смеси УФ-светом. Толуол, в зависимости от того, в каких условиях подвергается хлорированию, способен дать либо продукты замещения атомов водорода в бензольном кольце – для это нужно использовать те же условия что и при хлорировании бензола, либо продукты замещения атомов водорода в метильном радикале, если на него, как и на метан действовать хлором при облучении ультрафиолетом:
Как можно заметить хлорирование толуола в присутствии хлорида алюминия привело к двум разным продуктам – орто- и пара-хлортолуолу. Это обусловлено тем, что метильный радикал является заместителем I рода.
Если хлорирование толуола в присутсвии AlCl3 проводить в избытке хлора, возможно образование трихлорзамещенного толуола:
Аналогично при хлорировании толуола на свету при большем соотношении хлор/толуол можно получить дихлорметилбензол или трихлорметилбензол:
Нитрование
Замещение атомов водорода на нитрогруппу при нитровании толуола смесью концентрированных азотной и серной кислот приводит к продуктам замещения в ароматическом ядре, а не метильном радикале:
Алкилирование
Как уже было сказано, метильный радикал является ориентантом I рода, поэтому его алкилирование по Фриделю-Крафтсу приводит продуктам замещения в орто- и пара-положения:
Реакции присоединения
Толуол можно прогидрировать до метилциклогексана при использовании металлических катализаторов (Pt, Pd, Ni):
С6Н5СН3 + 9O2 → 7СO2 + 4Н2O
Неполное окисление
При действии такого окислителя, как водный раствор перманганата калия окислению подвергается боковая цепь. Ароматическое ядро в таких условиях окислиться не может. При этом в зависимости от pH раствора будет образовываться либо карбоновая кислота, либо ее соль:
История открытия бензола. Строение молекулы
Бензол был открыт в начале прошлого века. Это было загадочное вещество. Многие учёные пытались разгадать его строение, объяснить его свойства, но не могли. Почему?
Дело в том, что было установлено: состав молекулы бензола выражается формулой
Задание 21.1. По составу молекулы определите, является ли это вещество предельным или непредельным углеводородом.
Если сравнить состав бензола с соответствующим алканом, легко видеть, что бензол — сильно ненасыщенное соединение. Для того чтобы превратиться в алкан, бензол должен присоединить 8 атомов (4 молекулы) водорода. Но оказалось, что бензол, присоединяя 3 молекулы водорода, превращается в вещество циклического строения:
Значит, и бензол имеет циклическое строение!
Теперь возникает вопрос: какие связи соединяют атомы углерода в молекуле бензола? В 1865 году немецкий химик Кекуле* предложил такую модель молекулы бензола:

Эта модель объясняла многие свойства бензола, но не объясняла особенности химических свойств этого соединения. Ведь если углеводород имеет три двойные связи, то он должен давать качественные реакции на двойную (кратную) связь.
Вопрос. Какие вы знаете качественные реакции на кратную связь?
Но оказалось, что бензол эти качественные реакции не даёт, т. е.
- не обесцвечивает бромную воду (при нормальных условиях);
- не обесцвечивает раствор перманганата калия.
Значит, двойных связей в молекуле бензола НЕТ!
Дальнейшие исследования показали, что в молекуле бензола существует особая, очень прочная ароматическая связь. Рассмотрим её образование на примере бензола.
Как уже было сказано, бензол имеет циклическое строение, причём атомы углерода соединены в правильный шестиугольник при помощи простых σ-связей. Такие σ-связи соединяют атомы углерода и водорода:
Вопрос. Сколько связей образовал каждый атом углерода? Сколько электронов участвует в образовании этих связей?
Поскольку каждый атом углерода имеет по четыре валентных электрона, а в образовании трёх простых σ-связей участвовало по три электрона каждого атома, — у каждого атома углерода осталось по одному «лишнему» электрону (•). Эти электроны объединяются и образуют единую электронную систему — ароматическую связь:
Задание. Соедините точки линией, не отрывая карандаш от бумаги. Что у Вас получилось? Окружность.
Ароматическая связь в молекулах обозначается кружочком:

Формулы (1) и (1а) отражают строение одного и того же вещества бензола, состава С6Н6. Записывая формулу бензола (1а), следует помнить, что:
- в вершинах этого правильного шестиугольника находится атом углерода;
- каждый атом углерода соединён с одним атомом водорода.































