Типы сплавов
В зависимости от интенсивности нагрева, требуемого для перехода металла из одного состояния в другое, сплавы разделяют на несколько видов.
Легкоплавкие. Их обработка может производиться даже без специального оборудования. Температура плавления стали в градусах Цельсия составляет 600. К числу легкоплавких металлов относятся свинец, олово и цинк.
Особого внимания заслуживает ртуть, способная переходить в жидкое состояние при -39°С.
Среднеплавкие. Температура плавления сталей находится в пределах 600°С-1600°С. К этой категории относятся алюминий, медь, олово, некоторые виды нержавейки и различные сплавы с небольшим содержанием хрома. Среднеплавкие соединения получили наибольшее распространение в промышленности и в быту.
Тугоплавкие. Соединения, входящие в данную категорию, способны переходить из твердого состояния в жидкое при нагреве свыше 1600°С. Это высоколегированные металлы, в состав которых входят вольфрам, титан и хром. Благодаря этим добавкам металл приобретает повышенную прочность, устойчивость к коррозии и химическим воздействиям. В частности, к тугоплавким сплавам относится нержавейка.
При наиболее низких температурных показателях плавятся щелочные металлы. Соответственно, для перехода в жидкое состояние не щелочных металлов температурный диапазон значительно увеличивается.
Градус кипения
В процессе нагрева материала важно не достичь его кипения, при котором из жидкого состояния он переходит в газообразное. Поэтому градус кипения является не менее важным технологическим показателем
Градус кипения, как правило, вдвое выше градуса, при котором материалы расплавляются, и определяется при нормальном атмосферном давлении. При увеличении давления увеличивается и интенсивность нагрева. При уменьшении давления показатели уменьшаются.
Особенности углеродистой стали
Углеродистые соединения являются основным видом продукции, производимой на металлургических комбинатах. Кроме железа, в их состав входит углерод. Его концентрация не должна превышать 2,14%. В них присутствует небольшое количество примесей и легирующих компонентов в виде марганца, кремния и магния. Такие добавки позволяют улучшить их физические и химические показатели.
В зависимости от концентрации углерода углеродистые соединения делятся на следующие виды:
- низкоуглеродистые (содержание углерода не превышает 0,29%);
- среднеуглеродистые (до 0,6%);
- высокоуглеродистые (более 0,6%).
Углеродистые соединения используются в различных промышленных отраслях. В зависимости от сферы применения в них добавляются легирующие компоненты, позволяющие достичь специфических свойств, включая жаропрочность, коррозийную стойкость и пр. По этим критериям они подразделяются на следующие категории:
- конструкционные;
- инструментальные.
В инструментальные добавляется марганец, позволяющий значительно повысить качество металла. Температура плавления углеродистой стали составляет 1535°С.
Особенности легированной стали
В состав легированных соединений вводят дополнительные компоненты. В определенных количествах они придают им требуемые свойства. В зависимости от концентрации таких элементов они подразделяются на следующие виды:
- низколегированные (с концентрацией 2,5%);
- среднелегированные (до 10%);
- высоколегированные (свыше 10%).
За счет добавления дополнительных компонентов удается повысить прочность, коррозийную стойкость и улучшить другие характеристики. В качестве легирующих компонентов выступают хром, медь, никель, азот, ванадий и пр. Температура плавления легированной стали колеблется в пределах 1400°С-1480°С.
Особенности нержавейки
Нержавейка – это сплав, устойчивый к сухой и влажной коррозии, и невосприимчивый к воздействию агрессивных веществ. Чтобы придать ему необходимые свойства, в металл добавляются различные легирующие компоненты в виде хрома, никеля, магния, титана и пр. Температура плавления нержавеющей стали по Цельсию составляет 1350-1500 градусов.
Ниже представлена таблица, в которой указана температура плавления жаропрочной нержавеющей стали наиболее популярных марок.
| Марка | t°С |
| 12Х18Г9 | 1410 |
| Х20Н35 | 1410 |
| 12Х18Н9Т | 1425 |
| Х25С3Н | 1480 |
| 15Х25Т | 1500 |
Особенности инструментальной стали
Этот материал предназначен исключительно для изготовления инструментов. От конструкционного он отличается увеличенным содержанием углерода в количестве более 0,7%. Такие соединения в основном используются в машиностроении для обработки чермета и цветмета. Температура плавления нержавеющей стали, предназначенной для изготовления инструмента, составляет 1500°С.
Типы расплавов
Расплавы могут быть классифицированы по различным критериям, таким как химический состав, температура плавления и свойства. Вот несколько основных типов расплавов:
-
Металлические расплавы:
Металлические расплавы представляют собой смеси металлов или сплавы. Они обладают высокой электропроводностью и теплопроводностью, а также способностью формировать кристаллическую решетку. Примеры металлических расплавов включают легированные стали, бронзу и алюминиевые сплавы.
-
Неорганические соли:
Неорганические расплавы могут содержать соли, такие как хлориды, нитраты и сульфаты. Они имеют высокую температуру плавления и используются в различных промышленных процессах, например, для получения стекла или производства удобрений.
-
Полимерные расплавы:
Полимерные расплавы — это смеси полимеров или полимеров с добавками. Они обладают высокой вязкостью и включают такие материалы, как пластик, резина и клеи. Полимерные расплавы часто используются в промышленности для производства пластиковых изделий и упаковки.
-
Органические расплавы:
Органические расплавы состоят из органических соединений, таких как углеводороды или жидкие кристаллы. Они используются в химической промышленности для синтеза органических соединений и как растворители в лабораториях и производстве. Примеры органических расплавов включают этиленгликоль и бензол.
Это лишь несколько примеров типов расплавов, и в зависимости от химического состава и свойств материалов, расплавы могут иметь различные характеристики и применения.
Разделение металлов
В зависимости от температуры плавления металлы делятся на:
. Это цинк, свинец, виснут, олово.
Среднеплавкие: температура плавления колеблется от 600С о
. Это золото, медь, алюминий, магний, железо, никель и большая половина всех элементов.
Тугоплавкие: требуется температура свыше 1600С о
, чтобы сделать металл жидким. Сюда относятся хром, вольфрам, молибден, титан.
В зависимости от температуры плавления выбирают и плавильный аппарат. Чем выше показатель, тем прочнее он должен быть. Узнать температуру нужного вам элемента можно из таблицы.
Еще одной немаловажной величиной является температура кипения. Это величина, при которой начинается процесс кипения жидкостей, она соответствует температуре насыщенного пара, который образуется над плоской поверхностью кипящей жидкости
Обычно она почти в два раза больше, чем температура плавления.
Обе величины принято приводить при нормальном давлении. Между собой они прямопропорциональны.
- Увеличивается давление — увеличится величина плавления.
- Уменьшается давление — уменьшается величина плавления.
Таблица легкоплавких металлов и сплавов (до 600С
| Название элемента | Латинское обозначение | Температуры | |
| Плавления | Кипения | ||
| Олово | Sn | 232 С о | 2600 С о |
| Свинец | Pb | 327 С о | 1750 С о |
| Цинк | Zn | 420 С о | 907 С о |
| Калий | K | 63,6 С о | 759 С о |
| Натрий | Na | 97,8 С о | 883 С о |
| Ртуть | Hg | — 38,9 С о | 356.73 С о |
| Цезий | Cs | 28,4 С о | 667.5 С о |
| Висмут | Bi | 271,4 С о | 1564 С о |
| Палладий | Pd | 327,5 С о | 1749 С о |
| Полоний | Po | 254 С о | 962 С о |
| Кадмий | Cd | 321,07 С о | 767 С о |
| Рубидий | Rb | 39,3 С о | 688 С о |
| Галлий | Ga | 29,76 С о | 2204 С о |
| Индий | In | 156,6 С о | 2072 С о |
| Таллий | Tl | 304 С о | 1473 С о |
| Литий | Li | 18,05 С о | 1342 С о |
Таблица среднеплавких металлов и сплавов (от 600С
| Название элемента | Латинское обозначение | Температураы | |
| Плавления | Кипения | ||
| Алюминий | Al | 660 С о | 2519 С о |
| Германий | Ge | 937 С о | 2830 С о |
| Магний | Mg | 650 С о | 1100 С о |
| Серебро | Ag | 960 С о | 2180 С о |
| Золото | Au | 1063 С о | 2660 С о |
| Медь | Cu | 1083 С о | 2580 С о |
| Железо | Fe | 1539 С о | 2900 С о |
| Кремний | Si | 1415 С о | 2350 С о |
| Никель | Ni | 1455 С о | 2913 С о |
| Барий | Ba | 727 С о | 1897 С о |
| Бериллий | Be | 1287 С о | 2471 С о |
| Нептуний | Np | 644 С о | 3901,85 С о |
| Протактиний | Pa | 1572 С о | 4027 С о |
| Плутоний | Pu | 640 С о | 3228 С о |
| Актиний | Ac | 1051 С о | 3198 С о |
| Кальций | Ca | 842 С о | 1484 С о |
| Радий | Ra | 700 С о | 1736,85 С о |
| Кобальт | Co | 1495 С о | 2927 С о |
| Сурьма | Sb | 630,63 С о | 1587 С о |
| Стронций | Sr | 777 С о | 1382 С о |
| Уран | U | 1135 С о | 4131 С о |
| Марганец | Mn | 1246 С о | 2061 С о |
| Константин | 1260 С о | ||
| Дуралюмин | Сплав алюминия, магния, меди и марганца | 650 С о | |
| Инвар | Сплав никеля и железа | 1425 С о | |
| Латунь | Сплав меди и цинка | 1000 С о | |
| Нейзильбер | Сплав меди, цинка и никеля | 1100 С о | |
| Нихром | Сплав никеля, хрома, кремния, железа, марганца и алюминия | 1400 С о | |
| Сталь | Сплав железа и углерода | 1300 С о | |
| Фехраль | Сплав хрома, железа, алюминия, марганца и кремния | 1460 С о | |
| Чугун | Сплав железа и углерода | 1100 С о |
Таблица тугоплавких металлов и сплавов (свыше 1600С
| Название элемента | Латинское обозначение | Температуры | |
| Плавления | Кипения | ||
| Вольфрам | W | 3420 С о | 5555 С о |
| Титан | Ti | 1680 С о | 3300 С о |
| Иридий | Ir | 2447 С о | 4428 С о |
| Осмий | Os | 3054 С о | 5012 С о |
| Платина | Pt | 1769,3 С о | 3825 С о |
| Рений | Re | 3186 С о | 5596 С о |
| Хром | Cr | 1907 С о | 2671 С о |
| Родий | Rh | 1964 С о | 3695 С о |
| Рутений | Ru | 2334 С о | 4150 С о |
| Гафний | Hf | 2233 С о | 4603 С о |
| Тантал | Ta | 3017 С о | 5458 С о |
| Технеций | Tc | 2157 С о | 4265 С о |
| Торий | Th | 1750 С о | 4788 С о |
| Ванадий | V | 1910 С о | 3407 С о |
| Цирконий | Zr | 1855 С о | 4409 С о |
| Ниобий | Nb | 2477 С о | 4744 С о |
| Молибден | Mo | 2623 С о | 4639 С о |
| Карбиды гафния | 3890 С о | ||
| Карбиды ниобия | 3760 С о | ||
| Карбиды титана | 3150 С о | ||
| Карбиды циркония | 3530 С о |
Распечатать
Температуры плавления некоторых веществ[2]
| вещество | температура плавления () |
| гелий (при 2,5 МПа) | −272,2 |
| водород | −259,2 |
| кислород | −219 |
| азот | −210,0 |
| метан | −182,5 |
| спирт | −114,5 |
| хлор | −101 |
| аммиак | −77,7 |
| ртуть | −38,87 |
| водяной лёд | |
| бензол | +5,53 |
| цезий | +28,64 |
| галлий | +29,8 |
| сахароза | +185 |
| сахарин | +225 |
| олово | +231,93 |
| свинец | +327,5 |
| алюминий | +660,1 |
| серебро | +960,8 |
| золото | +1063 |
| медь | +1083,4 |
| кремний | +1415 |
| железо | +1539 |
| титан | +1668 |
| платина | +1772 |
| цирконий | +1852 |
| корунд | +2050 |
| рутений | +2334 |
| молибден | +2622 |
| карбид кремния | +2730 |
| карбид вольфрама | +2870 |
| осмий | +3054 |
| оксид тория | +3350 |
| вольфрам | +3422 |
| углерод (сублимация) | +3547 |
| карбид гафния | +3890 |
| карбид тантала-гафния | +3942 |
Температура плавления металлов
Разные вещества имеют различную температуру плавления. Принято делить металлы на:
- Легкоплавкие – их достаточно нагревать до 600 ⁰С, чтобы получать вещество в жидком виде.
- Среднеплавкие металлы расплавляются в диапазоне температур 600…1600 ⁰С.
- Тугоплавкими называют металлы, которые могут расплавляться при температуре более 1600 ⁰С.
В таблице по возрастанию показаны легкоплавкие металлы. Здесь видно, что самым необычным металлом является ртуть (Hg). В обычных условиях она находится в жидком состоянии. Этот металл имеет самую низкую температуру плавления.
Таблица 1, температуры плавления и кипения легкоплавких металлов:
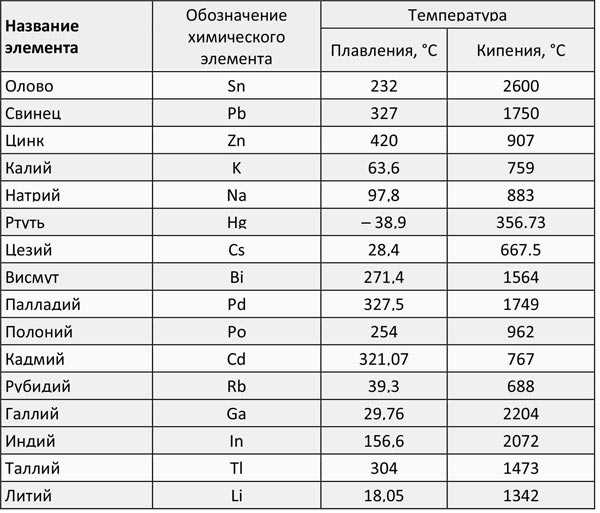
Таблица 2, температуры плавления и кипения среднеплавких металлов:
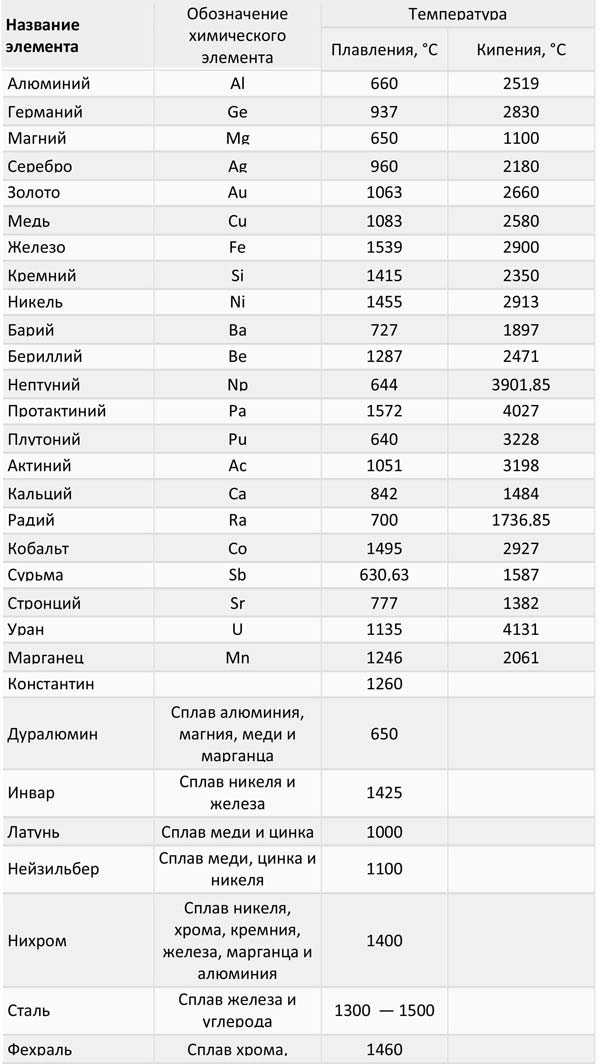
Таблица 3, температуры плавления и кипения тугоплавких металлов:
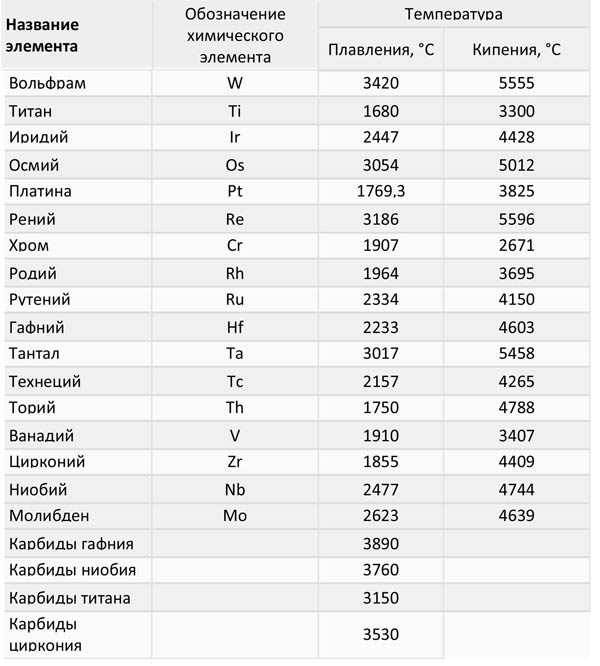
Чтобы вести процесс плавки используют разные устройства. Например, для выплавки чугуна применяют доменные печи. Для плавки цветных металлов производят внутренний нагрев с помощью токов высокой частоты.
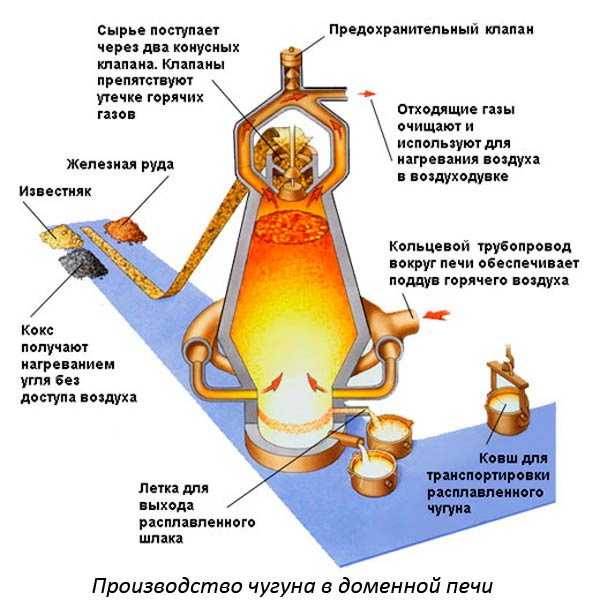
В изложницах, изготовленных из неметаллических материалов, находятся цветные металлы в твердом состоянии. Вокруг них создают переменное магнитное поле СВЧ. В результате кристаллические решетки начинают расшатываться. Молекулы вещества приходят в движение, что вызывает разогрев внутри всей массы.
При необходимости плавки небольшого количества легкоплавких металлов используют муфельные печи. В них температура поднимается до 1000…1200 ⁰С, что достаточно для плавки цветных металлов.
Черные металлы расплавляют в конвекторах, мартенах и индукционных печах. Процесс идет с добавлением легирующих компонентов, улучшающих качество металла.

Сложнее всего проводить работу с тугоплавкими металлами. Проблема в том, что нужно использовать материалы, имеющие температуру более высокую, чем температура плавления самого металла. В настоящее время авиационная промышленность рассматривает использование в качестве конструкционного материала Титан (Ti). При высокой скорости полета в атмосфере происходит разогрев обшивки. Поэтому нужна замена алюминию и его сплавам (AL).
Максимальная температура плавления этого довольного легкого металла привлекает конструкторов. Поэтому технологи разрабатывают технологические процессы и оборудование, чтобы производить детали из титана и его сплавов.
Как определить температуру плавления?
Существует несколько методов экспериментального определения температуры плавления.
- Капиллярный способ Измельченное твердое вещество необходимо поместить в капилляр с открытым концом. Капилляр нагревают в таких условиях, чтобы тонкое стекло не лопнуло. Когда все вещество переходит в жидкую фазу, температуру фиксируют.
- Открытый капиллярный метод Этот способ схож с предыдущим, но вместо закрытого капилляра используют открытый.
- Мгновенное плавление На металлический блок, нагретый до температуры на 10°С ниже справочной температуры плавления, кладут измельченные порции сухого вещества. Регулируют нагревание так, чтобы градус повышался на 1°С в минуту. Затем записывают изначальную температуру t1, при которой вещество приобретает свойства жидкости сразу после контакта с блоком. После нахождения данной величины нагревание приостанавливают и очищают место соприкосновения блока и вещества. При постепенном охлаждении продолжают класть на блок порции вещества. Таким образом устанавливают конечную температуру t2, при которой вещество перестает плавиться.
Формула определения температуры плавления по методу «мгновенного плавления»:
Тпл = (t1 + t2) / 2
Для определения температуры плавления твердых веществ, которые быстро превращаются в порошок, используют методы №1 и №3, а для аморфных веществ, плавящихся при температуре ниже 100°С, — метод №2.
Температуру плавления нельзя определить теоретическим путем с помощью формул. Ознакомиться с ней можно в специальном химическом справочнике.

График кристаллизации
Теперь перейдём к рассмотрению кристаллизации — процесса, обратного плавлению. Начинаем с точки предыдущего рисунка. Предположим, что в точке нагревание расплава прекратилось (печку выключили и расплав выставили на воздух). Дальнейшее изменение температуры расплава представлено на рис. (3).
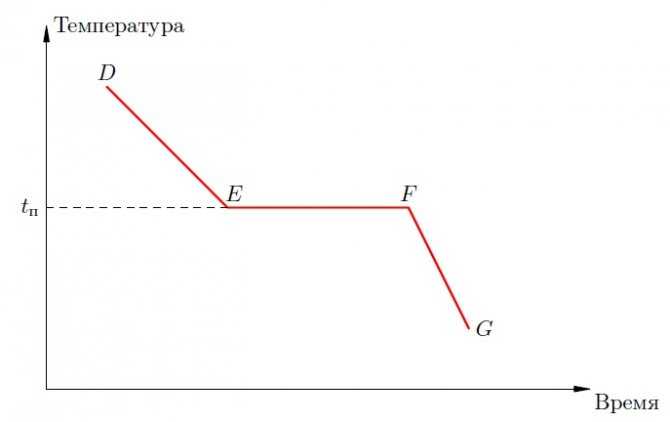
Рис. 3. График кристаллизации
Жидкость остывает (участок ), пока её температура не достигнет температуры кристаллизации, которая совпадает с температурой плавления .
С этого момента температура расплава меняться перестаёт, хотя тепло по-прежнему уходит от него в окружающую среду. На участке происходит кристаллизация расплава — его постепенный переход в твёрдое состояние. Внутри участка мы снова имеем смесь твёрдой и жидкой фаз, и чем ближе к точке , тем больше становится твёрдого вещества и тем меньше — жидкости.Наконец,вточке жидкостинеостаётсявовсе—онаполностьюкристаллизовалась.
Следующий участок соответствует дальнейшему остыванию твёрдого тела, возникшего в результате кристаллизации.
Нас опять-таки интересует участок фазового перехода : почему температура остаётся неизменной, несмотря на уход тепла?
Снова вернёмся в точку . После прекращения подачи тепла температура расплава понижается, так как его частицы постепенно теряют кинетическую энергию в результате соударений с молекулами окружающей среды и излучения электромагнитных волн.
Когда температура расплава понизится до температуры кристаллизации (точка ), его частицы замедлятся настолько, что силы притяжения окажутся в состоянии «развернуть» их должным образом и придать им строго определённую взаимную ориентацию в пространстве. Так возникнут условия для зарождения кристаллической решётки, и она действительно начнёт формироваться благодаря дальнейшему уходу энергии из расплава в окружающее пространство.
Одновременно начнётся встречный процесс выделения энергии: когда частицы занимают свои места в узлах кристаллической решётки, их потенциальная энергия резко уменьшается, за счёт чего увеличивается их кинетическая энергия — кристаллизующаяся жидкость является источником тепла (часто у проруби можно увидеть сидящих птиц. Они там греются!). Выделяющееся в ходе кристаллизации тепло в точности компенсирует потерю тепла в окружающую среду, и потому температура на участке не меняется.
В точке расплав исчезает, а вместе с завершением кристаллизации исчезает и этот внутренний «генератор» тепла. Вследствие продолжающегося рассеяния энергии во внешнюю среду понижение температуры возобновится, но только остывать уже будет образовавшееся твёрдое тело (участок ).
Как показывает опыт, при кристаллизации на участке выделяется ровно то же самое количество теплоты , которое было поглощено при плавлении на участке .
Свойства расплавов: вязкость и плавление
Расплав – это состояние вещества, при котором его твердая форма переходит в жидкую под воздействием тепла. В процессе плавления межмолекулярные силы преодолеваются и вещество становится мобильным, обладая определенными свойствами.
Одной из важных характеристик расплава является вязкость. Вязкость определяет способность расплава сопротивляться деформации и текучести. Она зависит от взаимодействия частиц между собой, молекулярной структуры расплава и его температуры.
Высокая вязкость означает, что расплав течет медленно и имеет большую сопротивляемость деформации. Низкая вязкость, напротив, предполагает быстрое течение и малую сопротивляемость деформации.
Описание вязкости расплава может быть выражено с помощью численной величины, называемой вязкостью динамической или кинематической вязкостью. Для измерения и объяснения этого свойства используется ряд методов и техник, включая вискозиметрию, течение внутренних и внешних течений и др.
Еще одним важным свойством расплавов является их температура плавления. Температура плавления – это температура, при которой твердое вещество переходит в жидкое состояние. Для каждого вещества существует определенная температура плавления, которая может быть как конкретным значением, так и диапазоном значений.
Температура плавления зависит от различных факторов, включая химическую структуру вещества, молекулярные силы, давление и др. Это свойство играет важную роль в различных процессах и технологиях, таких как плавка и формовка металлов, приготовление пищи, производство стекла и т. д.
Важно отметить, что свойства расплава могут варьироваться в зависимости от конкретного вещества и условий окружающей среды. Кроме того, изменение параметров плавления расплава может привести к изменению его физических и химических свойств, что можно использовать в различных процессах и применениях
Что такое расплав в химии
Расплавом в химии называется состояние вещества, при котором оно переходит из твердого в жидкое состояние под воздействием повышенной температуры. В жидком состоянии молекулы вещества находятся в постоянном движении, при этом они находятся достаточно близко друг к другу, чтобы образовывать слабые химические связи.
Расплавы широко используются в химической промышленности и лабораторных условиях для растворения веществ и проведения реакций. Они представляют собой удобную форму для манипулирования веществом и позволяют получать продукты химических реакций в жидком состоянии. Кроме того, расплавы можно использовать для контроля температуры реакций, так как они обычно имеют более низкие температуры плавления, чем сами вещества.
Расплавы могут быть однокомпонентными или многокомпонентными. В однокомпонентных расплавах все молекулы принадлежат только одному виду вещества. В многокомпонентных расплавах присутствуют молекулы нескольких различных веществ.
Одним из примеров многокомпонентного расплава является сплав, состоящий из двух или более металлов. Такой сплав обладает особыми свойствами благодаря взаимодействиям между различными молекулами веществ.
Свойства расплавов зависят от состава и структуры веществ, а также от условий их образования и использования. Расплавы могут быть высокотемпературными или низкотемпературными, иметь определенную вязкость и плотность, быть химически стабильными или реактивными и т.д.
Чугун и сталь
Чугун — это сплав углерода и железа, он содержит примеси марганца, кремния, серы и фосфора. Выдерживает невысокие напряжения и нагрузки. Один из его многочисленных плюсов — это невысокая стоимость для потребителей. Чугун бывает четырех видов:
Белый — имеет высокую прочность и плохую способность к обработке ножом. Виды сплава по увеличению количества углерода в составе: доэвтектический, эвтектический, заэвтектический. Его назвали белым из-за того, что в разломе он имеет белый цвет. А также белый чугун обладает особым строением металлической массы и большой изностойкостью. Полезен в изготовлении механических деталей, которые будут работать в среде с отсутствием смазки. Его используют для изготовления приведённых ниже видов чугуна.
Серый чугун — содержит углерод, кремний, марганец, фосфор и немного серы. Его можно легко получить, и он имеет плохие механические свойства. Используется для изготовления деталей, которые не подвергаются воздействию ударных нагрузок. В изломе есть серый цвет, чем он темнее, тем материал мягче. Свойства серого чугуна зависят от температуры среды, в которой он находится, и количества разных примесей.
Ковкий чугун — получают из белого в результате томления (длительного нагрева и выдержки). В состав вещества входят: углерод, кремний, марганец, фосфор, небольшое количество серы. Является более прочным и пластичным, легче поддаётся обработке.
Высокопрочный чугун — это самый прочный из всех видов чугунов. Содержит в себе углерод, марганец, серу, фосфор, кремний. Имеет большую ударную вязкость
Из такого важного металла делают поршни, коленчатые валы и трубы.
Температуры плавления стали и чугуна отличаются, как утверждает таблица, приведённая выше. Сталь имеет более высокую прочность и устойчивость к высоким температурам, чем чугун, температуры отличаются на целых 200 градусов. У чугуна это число колеблется приблизительно от 1100 до 1200 градусов в зависимости от содержащихся в нем примесей.
Масса
Вес материала меняется в зависимости от количества связанного углерода и наличия определенного процента пористости. Удельный вес чугуна при температуре плавления может существенно снижаться в зависимости от наличия в чугуне примесей.
Кроме этого линейное расширение металла и структура чугуна меняется в зависимости от состояния каждого показателя. То есть это зависимые величины.
Удельный вес каждого чугуна отличается в зависимости от вида материала. У серого чугуна удельная масса равна 7,1±0,2 г/см3, у белого — 7,5±0,2 г/см3 , у ковкого — 7,3±0,2 г/см3.
Объем
Объем чугуна, проходя через температуру фазовых превращений, достигает увеличения в 30%. Однако, при нагреве в 500ºС, объем увеличивается на 3%. Росту помогают графитообразующие элементы. Тормозят рост объема карбидообразующие составляющие. Та же росту препятствует нанесение на поверхность гальванических покрытий.
Содержание углерода обычно составляет не менее 2,14%. Благодаря углеродной доле чугун имеет отличную твердость. Однако пластичность и ковкость материала на этом фоне страдают.
О том, какова плотность чугуна, расскажем ниже.
Плотность
Плотность описываемого материала, чугуна, равна 7,2 гр/см3. Если сравнивать с чугуном другие металлы и сплавы, то это значение плотности достаточно высокое.
Благодаря хорошему значению плотности чугун широко применяют для литья разнообразных деталей в промышленности. По этому свойству чугун совсем незначительно уступает некоторым сталям.
ПРИМЕРЫ ЗАДАНИЙ
Часть 1
1. В процессе плавления кристаллическое твёрдое тело становится жидкостью. При этом
1) уменьшается внутренняя энергия тела 2) увеличивается средняя кинетическая энергия молекул 3) увеличивается внутренняя энергия тела 4) уменьшается средняя кинетическая энергия молекул
2. В одном сосуде находится лёд при температуре 0 °С, в другом — такая же масса воды при температуре 0 °С. Внутренняя энергия льда
1) равна внутренней энергии воды 2) больше внутренней энергии воды 3) меньше внутренней энергии воды 4) равна нулю
3. На рисунке представлен график зависимости температуры от времени для процесса нагревания льда. Процессу плавления льда соответствует участок графика
1) AB 2) BC 3) CD 4) DE
4. На рисунке приведён график зависимости температуры некоторого вещества от времени. Первоначально вещество находилось в жидком состоянии. Какая точка графика соответствует началу процесса отвердевания вещества?
5. На рисунке приведён график зависимости температуры некоторого вещества от времени. Первоначально вещество находилось в жидком состоянии. Какая точка графика соответствует окончанию процесса отвердевания вещества?
6. На рисунке изображён график зависимости температуры тела от времени. Первоначально тело находилось в жидком состоянии. Какой процесс характеризует отрезок БВ?
1) нагревание 2) охлаждение 3) плавление 4) кристаллизацию
7. На рисунке представлен график зависимости температуры ( t ) от времени ( tau ) при непрерывном нагревании и последующем непрерывном охлаждении вещества, первоначально находящегося в твёрдом состоянии. В каком состоянии находится вещество в точке Е?
1) только в жидком 2) только в твёрдом 3) только в газообразном 4) часть — в жидком, часть — в твёрдом
8. Удельную теплоту плавления можно рассчитать по формуле
9. Чему равно количество теплоты, которое необходимо затратить на полное превращение 2 кг свинца в жидкое состояние, если его начальная температура 27 °С?
1) 50 кДж 2) 78 кДж 3) 128 кДж 4) 15000 кДж
10. Какое количество теплоты выделяется при превращении 500 г воды, взятой при 0 °С, в лёд при температуре -10 °С? Потерями энергии на нагревание окружающего воздуха пренебречь.
1) 10500 Дж 2) 175 500 Дж 3) 165 000 Дж 4) 10500 Дж
11. На рисунке представлен график зависимости температуры некоторого вещества от полученного количества теплоты. Первоначально вещество находилось в твёрдом состоянии.
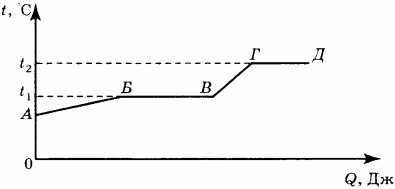
Используя данные графика, выберите из предложенного перечня два верных утверждения. Укажите их номера.
1) Удельная теплоёмкость вещества в твёрдом состоянии равна удельной теплоёмкости вещества в жидком состоянии. 2) Температура кипения вещества равна tx. 3) В точке В вещество находится в твёрдом состоянии. 4) В процессе перехода из состояния Б в состояние В внутренняя энергия вещества увеличивается. 5) Участок графика ГД соответствует процессу плавления вещества.
12. На рисунке представлены графики зависимости температуры от полученного количества теплоты для двух веществ одинаковой массы. Первоначально каждое из веществ находилось в твёрдом состоянии.
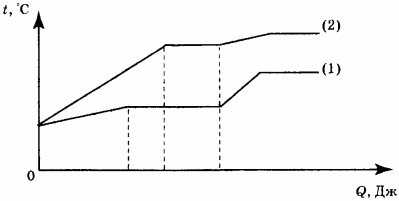
Используя данные графиков, выберите из предложенного перечня два верных утверждения. Укажите их номера.
1) Удельная теплоёмкость первого вещества в твёрдом состоянии меньше удельной теплоёмкости второго вещества в твёрдом состоянии. 2) В процессе плавления первого вещества было израсходовано большее количество теплоты, чем в процессе плавления второго вещества. 3) Представленные графики не позволяют сравнить температуры кипения двух веществ. 4) Температура плавления второго вещества выше. 5) Удельная теплота плавления у второго вещества больше.
Часть 2
13. Зависимость температуры 1 л воды от времени при непрерывном охлаждении представлена на графике. Какое количество теплоты выделилось при кристаллизации воды и охлаждении льда?
Фазовый переход в твердом веществе между двумя кристаллическими состояниями
Иначе ведет себя углерод. У него несколько фазовых переходов. Из жидкой формы, при отводе тепла, он переходит в кристаллическую фазу – графит; при высоком давлении более 120 000 атм. жидкий углерод кристаллизуется в алмаз. Кроме того, есть фазовый переход между двумя твердыми кристаллическими фазами: графитом и алмазом.
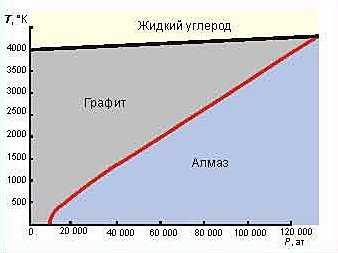
На рисунке красной линией показана диаграмма фазового перехода между алмазом и графитом. Температура фазового перехода зависит от давления, процессы, происходящие в твердом теле, аналогичны кристаллизации воды: если тепло подводить, то алмаз переходит в графит; если тепло отводить при соответствующем высоком давлении, то происходит переход, кристаллизация графита в алмаз. Можно видеть, что переходы между алмазом и графитом совершаются при высоких температурах и давлениях, а при нормальном давлении и температуре алмаза вроде бы и не должно быть. Действительно, при низком давлении графит нельзя превратить в алмаз. Но если алмаз образовался под воздействием высокого давления, при охлаждении и уменьшении давления он сохраняет свою структуру: это метастабильное состояние. Действительно, из всех кристаллов алмаз самый нестойкий: при нагревании до 1400°С он превращается в графит – устойчивую при нормальном давлении фазу.
Температура кипения и плавления металлов
В таблице представлена температура плавления металлов tпл, их температура кипения tк при атмосферном давлении, плотность металлов ρ при 25°С и теплопроводность λ при 27°С. Температура плавления металлов, а также их плотность и теплопроводность приведены в таблице для следующих металлов: актиний Ac, серебро Ag, алюминий Al, золото Au, барий Ba, берилий Be, висмут Bi, кальций Ca, кадмий Cd, кобальт Co, хром Cr, цезий Cs, медь Cu, железо Fe, галлий Ga, гафний Hf, ртуть Hg, индий In, иридий Ir, калий K, литий Li, магний Mg, марганец Mn, молибден Mo, натрий Na, ниобий Nb, никель Ni, нептуний Np, осмий Os, протактиний Pa, свинец Pb, палладий Pd, полоний Po, платина Pt, плутоний Pu, радий Ra, рубидий Pb, рений Re, родий Rh, рутений Ru, сурьма Sb, олово Sn, стронций Sr, тантал Ta, технеций Tc, торий Th, титан Ti, таллий Tl, уран U, ванадий V, вольфрам W, цинк Zn, цирконий Zr.
По данным таблицы видно, что температура плавления металлов изменяется в широком диапазоне (от -38,83°С у ртути до 3422°С у вольфрама). Низкой положительной температурой плавления обладают такие металлы, как литий (18,05°С), цезий (28,44°С), рубидий (39,3°С) и другие щелочные металлы.
Наиболее тугоплавкими являются следующие металлы: гафний, иридий, молибден, ниобий, осмий, рений, рутений, тантал, технеций, вольфрам. Температура плавления этих металлов выше 2000°С.
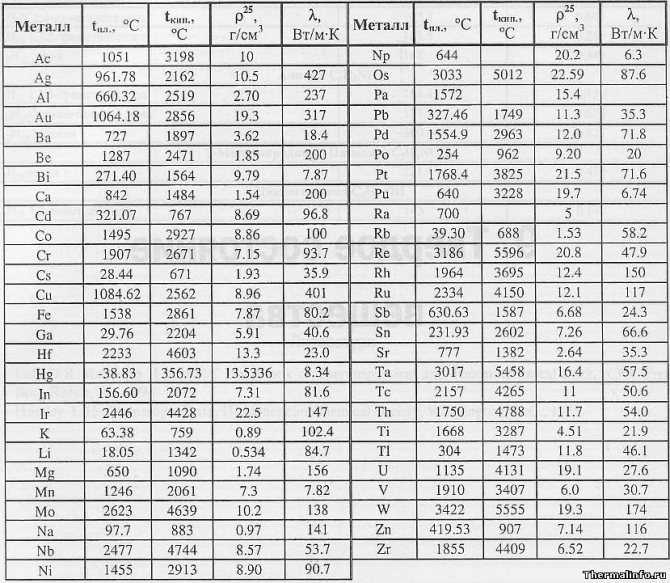
Приведем примеры температуры плавления металлов, широко применяемых в промышленности и в быту:
- температура плавления алюминия 660,32 °С;
- температура плавления меди 1084,62 °С;
- температура плавления свинца 327,46 °С;
- температура плавления золота 1064,18 °С;
- температура плавления олова 231,93 °С;
- температура плавления серебра 961,78 °С;
- температура плавления ртути -38,83°С.
Максимальной температурой кипения из металлов, представленных в таблице, обладает рений Re — она составляет 5596°С. Также высокими температурами кипения обладают металлы, относящиеся к группе с высокой температурой плавления.
Плотность металлов в таблице находится в диапазоне от 0,534 до 22,59 г/см3, то есть самым легким металлом является литий, а самым тяжелым металлом осмий. Следует отметить, что осмий имеет плотность большую, чем плотность урана и даже плутония при комнатной температуре.
Теплопроводность металлов в таблице изменяется от 6,3 до 427 Вт/(м·град), таким образом хуже всего проводит тепло такой металл, как нептуний, а лучшим теплопроводящим металлом является серебро.
Расплав в химии: определение и свойства
Расплав — это жидкое состояние вещества, при котором оно полностью или частично теряет свою кристаллическую структуру и превращается в жидкость. Расплавы широко используются в химической промышленности и лабораторных исследованиях.
Определение:
Расплав — это состояние вещества, которое проявляется в мягкости, пластичности и течении под воздействием небольшой силы. Обычно расплав образуется при нагревании твёрдого вещества до достаточно высокой температуры.
Свойства расплавов:
- Температура плавления: расплав возникает при достижении определенной температуры, называемой температурой плавления. Для разных веществ эта температура может существенно отличаться.
- Вязкость: расплавы могут быть разных вязкостей — от жидких и текучих до вязких и пластичных. Вязкость определяется химическим составом и структурой вещества.
- Теплопроводность: расплавы обладают разной теплопроводностью в зависимости от их состава и структуры.
- Растворительная способность: некоторые расплавы могут растворять другие вещества, образуя гомогенные системы.
- Теплоемкость: расплавы обладают определенной теплоемкостью, которая определяет, сколько теплоты требуется для нагрева или охлаждения расплава.
Применение расплавов:
- В процессе плавления металлов для получения различных их форм (слитков, профильной продукции и т.д.).
- В химической промышленности расплавы используются для создания легированных сплавов, получения различных химических соединений и производства полимеров.
- В лабораторных исследованиях расплавы применяются для проведения химических реакций, определения различных свойств веществ, синтеза новых соединений.
Использование расплавов в химии имеет широкий спектр применений и является важной составляющей многих процессов и исследований, обеспечивая удобство работы с твёрдыми веществами и открывая новые возможности. Оказывая влияние на свойства и структуру веществ, расплавы играют важную роль в различных областях химии и науки в целом





























