1.1 Диаграммы состояния
Диаграммы состояния, или диаграммы фазового равновесия в
удобной графической форме показывают фазовый состав сплава в зависимости от
температуры и концентрации. Диаграммы состояния строят для условий равновесия (окончательное
состояние). Равновесное состояние соответствует минимальному значению свободной
энергии. Это состояние может быть достигнуто только при очень малых скоростях
охлаждения или длительном нагреве. Однако истинное равновесие достигается
редко, наиболее часто системы находятся в метастабильном состоянии (неустойчивом),
и под воздействием внешних факторов могут переходить в другие более устойчивые
состояния. Метастабильные состояния нередко сообщают сплавам высокие
механические и другие свойства.
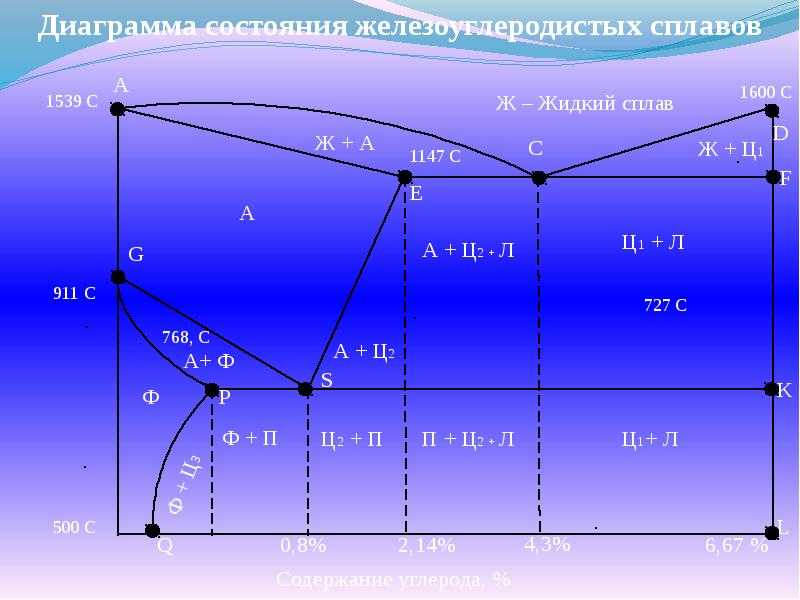
Диаграмма состояния «железо — цементит»
Диаграмма (рис. 7) показывает фазовый состав и структуру сплавов с концентрацией от чистого железа до цементита (6,67%). Сплавы с содержанием углерода 2,14% называют сталью, а от 2,14 до 6,67% — чугуном.
Первичная кристаллизация, т.е. затвердевание жидкого сплава, начинается при температурах, соответствующих линии ликвидуса. Точка А на этой диаграмме соответствует температуре плавления 1539°С (затвердевания) железа, точка D — температура плавления (затвердения) ~ 1600°С цементита.
Линия солидуса AEСF соответствует температурам конца затвердевания. При температурах, соответствующих линии АС, из жидкого сплава кристаллизуется аустенит, а линии CD — цементит, называемый первичным цементитом.
В точке С при 1147°С и содержании углерода 4,3% из жидкого сплава одновременно кристаллизуются аустенит (А) и цементит (Ц) (первичный), образуя эвтектику — ледебурит (Л).
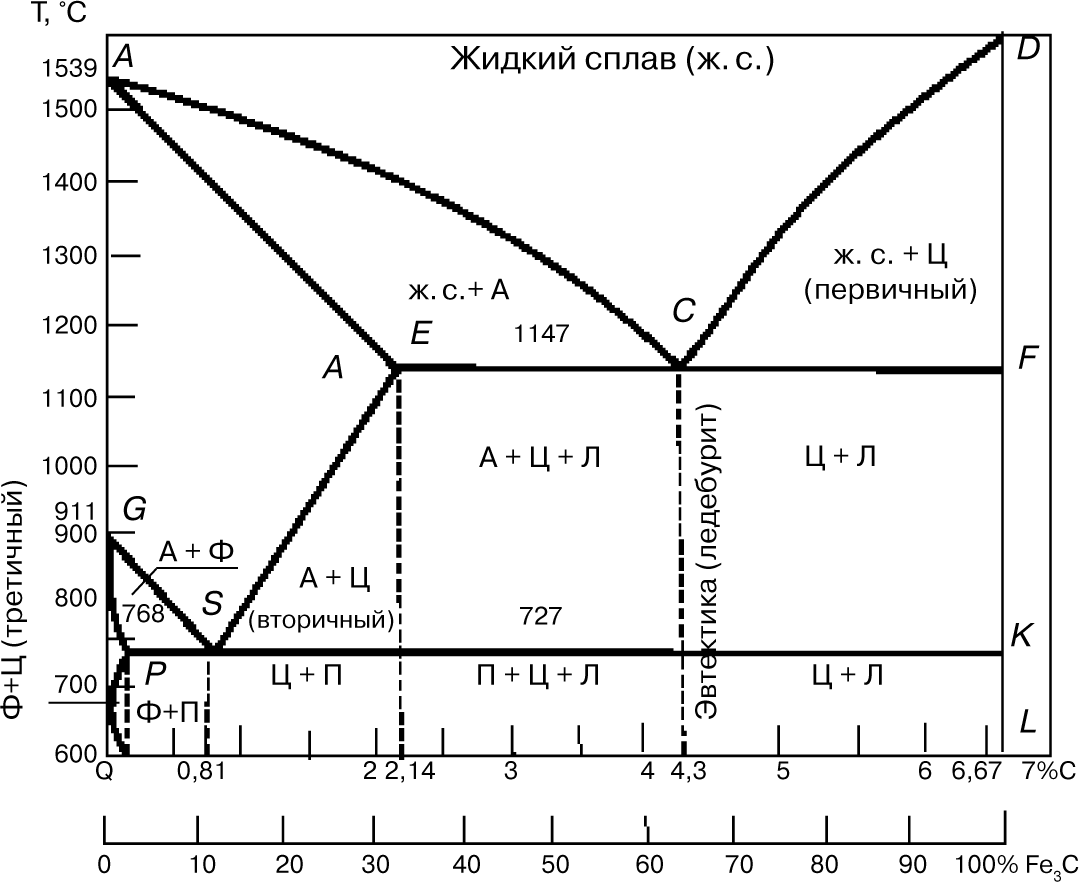
При температурах, соответствующих линии солидуса АЕ, сплавы с содержанием углерода до 2,14% окончательно затвердевают с образованием аустенита. На линии солидуса ECF сплавы с содержанием углерода от 2,14 до 6,67% окончательно затвердевают с образованием эвтектики (ледебурита) и структур, образовавшихся ранее из жидкого сплава, а именно: в интервале 2,14…4,3%, С — аустенита, а в интервале 4,3…6,67% С — цементита первичного.
В результате первичной кристаллизации во всех сплавах с содержанием углерода до 2,14% (т.е. в сталях) образуется однофазная структура — аустенит. В сплавах с содержанием углерода более 2,14% (т.е. в чугунах) при первичной кристаллизации образуется эвтектика ледебурита.
Вторичная кристаллизация (превращение в твердом состоянии) происходит при температурах, соответствующих линиям GSE, PSK и GPQ. Превращения в твердом состоянии происходят вследствие перехода железа из одной аллотропической модификации в другую ( в ) и в связи с изменением растворимости углерода в аустените и феррите. С понижением температуры растворимость уменьшается. Избыток углерода выделяется из твердых растворов в виде цементита. В области диаграммы AGSE находится аустенит.
Диаграмма состояний для случая неограниченной растворимости компонентов в твердом состоянии

Диаграмма состояния — графическое изображение фазового состояния сплавов в зависимости от температуры и концентрации компонентов. Рассмотрим диаграмму состояния сплавов системы «медь — никель», которая является диаграммой для случая неограниченной растворимости компонентов в твердом состоянии (рис. 3).
Температура плавления меди 1083°С, никеля — 1445°С. Чистые металлы имеют одну критическую точку — температуру затвердевания (кристаллизации), а сплавы — две, т.е. сплавы, в отличие от чистых металлов, кристаллизуются в интервале температур. Например, кристаллизация сплава начинается при температуре t1, при этой температуре из жидкого сплава начинают выпадать первые кристаллы твердого раствора, а заканчивается кристаллизация при температуре t3. При этой температуре затвердевает последняя капля жидкого сплава. Разная температура конца кристаллизации сплавов свидетельствует о том, что состав твердой фазы непрерывно изменяется.
Для построения диаграммы состояния рассматриваемой системы на оси абсцисс сетки в координатах температура — концентрация откладывают составы пяти сплавов и восстанавливают из каждой точки вертикальные линии. После этого переносят на эти вертикальные линии с кривых охлаждения сплавов критические точки, а на левой и правой ординатах температур отмечают температуры кристаллизации чистых металлов — меди (100%) и никеля (100%). Соединив плавными кривыми температуры начала и конца кристаллизации всех сплавов, получают диаграмму состояния сплавов системы «медь — никель» с неограниченной растворимостью компонентов в твердом состоянии.
Верхняя линия на диаграмме обозначает начало затвердевания при охлаждении или конец расплавления при нагреве, нижняя — соответственно конец затвердевания или начало плавления. Эта диаграмма состояния сплава меди и никеля имеет три области. Область существования жидкого расплава
(1) лежит выше верхней линии, соединяющей точки плавления меди и никеля, а область существования кристаллических твердых растворов (2) — ниже нижней линии. Между этими линиями находится двухфазная область (3), в которой одновременно существуют расплав и кристаллы твердого раствора. Верхнюю границу этой области называют линией ликвидус, а нижнюю — линией солидус («ликвидус» в переводе с латинского означает жидкий, «солидус» — твердый). По диаграмме состояния можно определить концентрации твердой и жидкой фаз в сплаве при его кристаллизации.
Диаграмма состояния «железо — графит»
Систему «железо — цементит» называют метастабильной, т.е. неустойчивой, так как при определенных условиях цементит распадается на аустенит и свободный углерод в виде графита. При очень медленном охлаждении из расплава в процессе кристаллизации углерод выделяется в виде графита. Систему «железо — графит» называют стабильной.
Процесс кристаллизации графита в сплавах железа с углеродом называют графитизацией. Она может происходить и в твердом состоянии, поскольку цементит при высоких температурах неустойчив. В этом случае графитизация происходит в несколько накладывающихся стадий:
- распад цементита и растворение атомов углерода в аустените;
- образование центров графитизации в аустените;
- диффузия атомов углерода в аустените к центрам графитизации;
- рост выделений графита.
На рис. 8 показана совмещенная диаграмма: сплошными линиями изображена метастабильная диаграмма «железо — цементит», штриховыми линиями — стабильная диаграмма. По диаграмме «железо — цементит» в области чугунов получают белые чугуны, а по диаграмме «железо — графит» — серые чугуны.
На диаграмме «железо — графит» горизонтальные линии E′C′F ′ и P ′S′K′ лежат несколько выше, а наклонные линии C′D′ и E′S′ — несколько левее соответствующих линий диаграммы «железо — цементит». На диаграмме «железо — графит» линия AC′D′ — линия ликвидуса. При охлаждении расплава по ветви АС выделяется аустенит, а по ветви C′D′ — графит (первичный).

На линии солидуса E′C′F′ при температуре 1153°С образуется эвтектика, состоящая из графита и аустенита. Ее называют графитной эвтектикой. При понижении температуры в системе «железо — графит» из аустенита будет выделяться графит, который называют вторичным. На линии P′S′K′ при температуре 738°С аустенит, содержащий 0,7% углерода (точка S′), распадается, образуя эвтектоид, состоящий из феррита и графита. Этот эвтектоид называют графитным. После полного охлаждения структура состоит из феррита и графита (эвтектического, вторичного и эвтектоидного).
1.3 Процесс кристаллизации сплавов
В жидком состоянии большинство металлов неограниченно
растворяется друг в друге, образуя однородный раствор (исключение: Fe — Pb, Cu — Pb).
Кристаллизация в сплаве начинается только при
переохлаждении, с образованием зародышей и их последующего роста.
Любые фазы, образующиеся в сплаве, отличаются по составу от
исходного жидкого раствора, поэтому для образования устойчивого зародыша
необходимы не только гетерофазные (по плотности) флуктуации, но и флуктуации
концентрации (рис.1).

Рисунок 1.
Флуктуациями концентрации называют временно возникающие
отклонения химического состава сплава в отдельных малых объёмах жидкого
раствора от среднего его состава. Такие флуктуации возникают вследствие
диффузионного перемещения атомов вещества.
2.1 Диаграмма состояния сплавов, образующих неограниченные твердые растворы
Диаграмма состояния для случая полной взаимной растворимости компонентов А и В в жидком и твердом состояниях в зависимости от концентрации и температуры дана на рис.1.
Рисунок 1. Диаграмма состояния с неограниченной растворимостью компонентов
Если два компонента неограниченно растворяются в жидком и твердом состояниях, то возможно существование только двух фаз — жидкого раствора Ж (L) и твердого раствора (a). Следовательно, трех фаз быть не может, кристаллизация не наблюдается при постоянной температуре и горизонтальной линии на диаграмме нет.
При температуре выше линии tАаtВ, называемой линией ликвидус, существует только жидкая фаза Ж. В этой области свободная энергия жидкой фазы Fж ниже свободной энергии твердого раствора Fa, состоящего из компонентов А и В.
В области ниже линии tАбtВ, называемой линией солидус, устойчив a — твердый раствор, так как Fa< Fж.
Между линиями ликвидус и солидус в равновесии находятся жидкая фаза и a-твердый раствор.
Диаграмма состояния строится методом термического анализа.
Кристаллизация чистого компонента А: равномерное понижение температуры до значения tА (температура плавления компонента А), при которой компонент А затвердевает (до tА — С = 1 + 1 — 1 = 1). На кривой отмечается остановка (горизонтальная линия), так как согласно правилу фаз только при этой температуре одновременно могут существовать две фазы — твердая и жидкая (С=1+1-2=0). После затвердевания (Ф = 1), температура снова равномерно понижается С = 1 + 1 — 1 = 1. Аналогично для компонента В (рисунок 1).
При охлаждении сплава I температура понижается до t1 (C=2+1-1=2), при которой начинается кристаллизация, на кривой охлаждения наблюдается перегиб, связанный с уменьшением скорости охлаждения вследствие выделения скрытой теплоты кристаллизации.
Начиная от температуры t1, из Ж-фазы кристаллизуется твердый раствор. Процесс кристаллизации идет при понижающейся температуре (С=2+1-2=1), существует две фазы: Ж и a.
При достижении t2 сплав затвердевает и при более низких температурах существует только a — твердый раствор.
Если найденные точки перенести на диаграмму, и одноименные точки соединить плавными линиями, то получится диаграмма состояния системы сплавов А и В, образующих непрерывный ряд твердых растворов (рисунок 1).
В интервале температур между линиями ликвидус и солидус две фазы — жидкий сплав и a- твердый раствор.
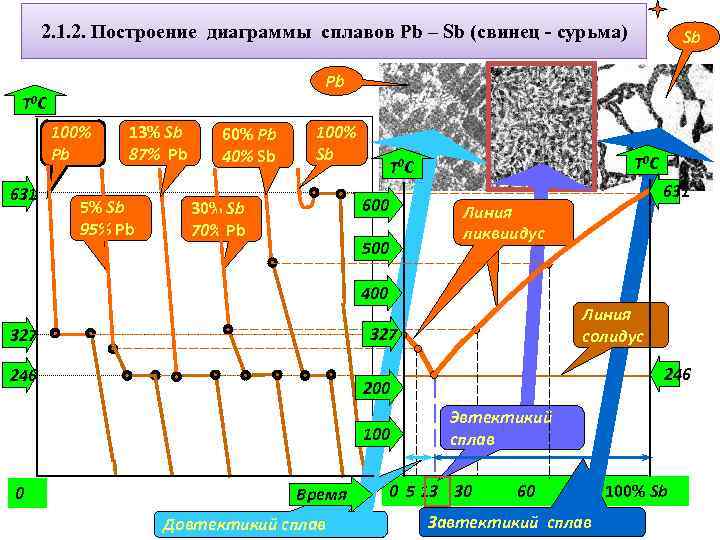
Шпаргалки по материаловедению — Правило отрезков
Saturday, 23 January 2016 13:06
administrator
| Cмотрите так же… |
|---|
| Шпаргалки по материаловедению |
| Особенности атомно-кристаллического строения металлов |
| Кристаллизация металлов |
| Механизм процесса кристаллизации металлов |
| Сплавы – механические смеси |
| Методика построения 2х компонентных диаграмм состояния |
| Сплавы – твердые растворы |
| Диаграмма состояния сплавов с неограниченной растворимостью |
| Диаграмма состояния сплавов с ограниченной растворимостью |
| Правило отрезков |
| Закон Курнакова |
| Механические свойства металлов и методы их определения |
| Сплавы железа с углеродом |
| Диаграмма состояния железо – углеродистых сплавов |
| Процессы при структурообразовании железоуглеродистых сплавов |
| Чугуны. Химический состав, классификация и назначение серых чугунов |
| Влияние скорости охлаждения на процесс графитизации в серых чугунах |
| Ковкие чугуны и высокопрочные чугуны |
| Первое основное превращение стали (перлит -> аустенит) |
| Второе основное превращение стали (аустенит ->перлит) |
| Мартенситное превращение и его особенности |
| Четвертое основное превращение (превращение мартенсита при отпуске) |
| Отжиг стали, виды отжига, режим, назначение |
| Нормализация сталей |
| Закалка стали. Условия полной закалки сталей. |
| Отпуск углеродистых сталей |
| Определение критических точек в стали методом пробных закалок. |
| Легированные стали, особенность химического состава |
| Классификация легированных сталей |
| Особенности термической обработки инструментальных быстрорежущих сталей |
| Цементация стали |
| Термическая обработка после цементации |
| Азотирование |
| Закалка токами высокой частоты |
| Отпускная хрупкость легированных сталей |
| Инструментальные стали |
| Штамповые стали для холодного и горячего деформирования металла |
| Полимеры и их классификация |
| All Pages |
Page 10 of 38
Правило отрезков
Количественный структурно-фазовый анализ сплава.
Пользуясь диаграммой состояния можно для любого сплава при любой температуре определить не только число фаз, но и их состав и количественное соотношение. Для этого используется правило отрезков. Для проведения количественного структурно-фазового анализа через заданную точку проводят горизонталь (коноду) до пересечения с ближайшими линиями диаграммы (ликвидус, солидус или оси компонентов).
а). Определение состава фаз в точке m:
Для его определения через точку m проводят горизонталь до пересечения с ближайшими линиями диаграммы: ликвидус и солидус.
Состав жидкой фазы определяется проекцией точки пересечения горизонтали с линией ликвидус p на ось концентрации.
Состав твердой фазы определяется проекцией точки пересечения горизонтали с линией солидус q (или осью компонента) на ось концентрации.
Состав жидкой фазы изменяется по линии ликвидуса, а состав твердой фазы – по линии солидуса.
С понижением температуры состав фаз изменяется в сторону уменьшения содержания компонента В.
б). Определение количественного соотношения жидкой и твердой фазы при заданной температуре (в точке m):
Количественная масса фаз обратно пропорциональна отрезкам проведенной коноды.Рассмотрим проведенную через точку m коноду и ее отрезки.
Количество всего сплава (Qсп) определяется отрезком pq.
Отрезок, прилегающий к линии ликвидус pm, определяет количество твердой фазы.
Отрезок, прилегающий к линии солидус (или к оси компонента) mq, определяет количество жидкой фазы.
Last Updated on Saturday, 23 January 2016 13:20
1.2 Правило фаз
Диаграммы фазового равновесия характеризуют окончательное состояние сплавов, то есть после того как все превращения в них произошли и полностью закончились. Это состояние зависит от внешних условий (Т С; Р, МПа) и характеризуется числом и концентрацией образовавшихся фаз. Закономерность изменения числа фаз в гетерогенной системе определяется правилом фаз.
Правило фаз устанавливает зависимость между числом степеней свободы, числом компонентов и числом фаз и выражается уравнением
С = К — Ф + 2,
где С — число степеней свободы системы (или вариантность);
К — число компонентов, образующих систему;
2 — число внешних факторов (Т и Р);
Ф — число фаз, находящихся в равновесии.
Под числом степеней свободы (вариантностью системы) понимают возможность изменения температуры, давления и концентрации без изменения числа фаз, находящихся в равновесии.
При нормальных условиях изменяется только один фактор -ТС, Р =const, тогда:
С=К — Ф + 1.
Число степеней свободы не может быть меньше нуля, тогда К-Ф+1>0, а Ф<К+1, то есть число фаз в сплаве, не может быть больше чем число компонентов плюс единица. Таким образом, в двойной системе может быть не более трёх фаз.
При С = 0 — существует в равновесии сразу три фазы — имеется нонвариантное равновесие (безвариантное). При таком равновесии сплав может существовать только при условии — постоянная температура и определённый состав всех фаз, находящихся в равновесии. То есть кристаллизация (или превращение) начинается и заканчивается при постоянной температуре. Если С =1 или 2, то кристаллизация или превращение протекает с течением времени в интервале температур.
Диаграмма состояния сплавов для случая ограниченной растворимости компонентов в твердом состоянии
Эта диаграмма состояний содержит три фазы — жидкий раствор, твердый раствор компонента В в компоненте А () и твердый раствор компонента А в компоненте В (α). Линия диаграммы KCD — линия ликвидуса, линия KECFD — линия солидуса (рис. 5). Кристаллы α выделяются из жидкого сплава (ж. с.) по линии ликвидуса КС, а кристаллы β — по линии CD. Затвердевание сплавов происходит по линии солидуса КЕ с образованием кристаллов α и по линии DF — с образованием кристаллов β. Одновременная кристаллизация α- и β-фаз с образованием механической смеси кристаллов этих фаз происходит на линии солидуса ECF.

Сплав состава точки С после затвердевания называется эвтектическим, поскольку он состоит только из одной эвтектики α + β. Составы сплавов, лежащих левее эвтектической точки С на линии ЕС после затвердевания, называются доэвтектическими сплавами и имеют структуру α + эвтектика (α + β). Составы сплавов, лежащих правее точки С на линии CF после затвердевания, называются заэвтектическими сплавами и имеют структуру β + эвтектика (α + β).
Предельная растворимость компонента В в А характеризуется точкой Е, а А в В — точкой F. При кристаллизации сплавов, состав которых находится левее точки S (или правее точки М), при любой температуре в твердом состоянии все количество компонента В (или А) находится в твердом растворе, и структура таких сплавов состоит из зерен α (или β).
В сплавах, состав которых находится между точками S и Е′, образовавшихся при затвердевании, кристаллы α при понижении температуры ниже линии ES пересыщены компонентом В, и поэтому из них происходит выделение избыточных кристаллов. Это кристаллы β концентрации точки М, называемые вторичными (βII). Такие сплавы после полного охлаждения имеют структуру, состоящую из кристаллов α состава точки S и кристаллов βII, т.е. α + βII.
В сплавах состава линии ЕС, имеющих после затвердевания структуру α + эвтектика (α + β), из кристаллов α выделяются кристаллы β, и после полного охлаждения структура будет α + эвтектика (α + β) + βII.
Структурные составляющие железоуглеродистых сплавов
Основными компонентами, от которых зависят структура и свойства железоуглеродистых сплавов, являются железо и углерод. Чистое железо — металл серебристо-белого цвета; температура плавления 1539°С. Железо имеет две полиморфные модификации: α и γ. Модификация α существует при температурах ниже 91°С и выше 1392°С; γ-железо — при температуре 911…1392°С. В зависимости от температуры и концентрации углерода железоуглеродистые сплавы имеют следующие структурные составляющие:
- Феррит (Ф) — твердый раствор внедрения углерода в α-железе. Растворимость углерода в α-железе при комнатной температуре до 0,005%; наибольшая растворимость — 0,02% при 727°С. Феррит имеет незначительную твердость (НВ = 80…100) и прочность (σв = 250 МПа), но высокую пластичность (δ = 50%; Ψ = 80%), где σв — предел прочности; δ — относительное удлинение; Ψ — относительное сужение.
- Аустенит (А) — твердый раствор внедрения углерода в γ-железе. В железоуглеродистых сплавах он может существовать только при высоких температурах. Предельная растворимость углерода в γ-железе — 2,14% при температуре 1147°С и 0,8% — при 727°С. Аустенит имеет твердость НВ = 160…200 и весьма пластичен (δ = 40…50%).
- Цементит (Ц) — химическое соединение железа с углеродом (карбид железа Fe3C). В цементите содержится 6,67% углерода. Температура плавления цементита около 1600°С. Он очень тверд (НВ » 800), хрупок и практически не обладает пластичностью.
- Графит — это свободный углерод, мягкий (НВ = 3) и обладает низкой прочностью. В чугунах и графитизированной стали содержится в виде включений различных форм (пластинчатой, шаровидной и др.). С изменением формы графитовых включений меняются механические и технологические свойства сплава.
- Перлит (П) — механическая смесь феррита и цементита, содержащая 0,8% углерода. Перлит может быть пластинчатым и зернистым (глобулярным), что зависит от формы цементита и определяет механические свойства перлита. При комнатной температуре зернистый перлит имеет предел прочности σв ≈ 800 МПа; относительное удлинение δ =15%; твердость НВ = 160.
- Ледебурит (Л) — механическая смесь аустенита и цементита, содержащая 4,3% углерода. Ледебурит образуется при затвердевании жидкого расплава при 1147°С. Ледебурит имеет твердость НВ = 600…700 и большую хрупкость.
Помимо перечисленных структурных составляющих, в железоуглеродистых сплавах могут быть нежелательные неметаллические включения: окислы, нитриды, сульфиды, фосфиды — соединения с кислородом, азотом, серой и фосфором.
2.2 Кристаллизация твердых растворов
Рассмотрим более подробно процесс кристаллизации сплава,
содержащего 60% компонента В. При температуре t1
сплав находится в жидком состоянии. В нем имеется равновесный набор фазовых и
концентрационных флуктуаций (отклонение от среднего химического состава). При
охлаждении в интервале температур t1 до t2 — количество размер флуктуаций при охлаждении
увеличивается по отношению к a- фазе. Ниже
т.2, (то есть примем т.3) начинается процесс кристаллизации, критический размер
зародыша достигает максимальной величины. Ниже t2
сплав является двухфазным (Ж и a
— кристаллы). Двухфазное состояние существует в интервале температур t2 — t5 (рисунок
2).
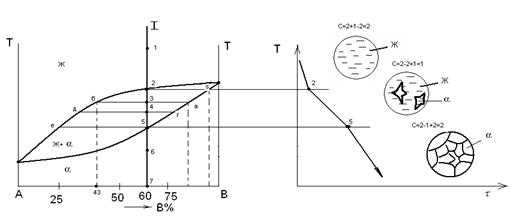
Рисунок 2.
В процессе кристаллизации (при каждой Т С) изменяется
и концентрация фаз, и количество каждой фазы (при кристаллизации количество
твердой фазы увеличивается, а жидкой уменьшается). В любой точке диаграммы, когда
существует две фазы, можно определить количество обеих фаз и их концентрацию. Для
этого служит правило рычага, или правило отрезков.